题目内容
在呼吸面具和潜水艇中可用过氧化钠作为供养剂.请选用适当的化学试剂和实验用品.用图中的实验装置进行试验,证明过氧化钠可作供氧剂.
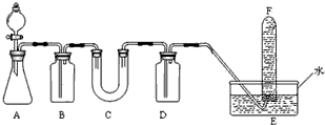
(1)A是制取CO2的装置.写出A中发生反应的化学方程式
(2)填写表中空格
(3)写出过氧化钠与二氧化碳反应的化学方程式
(4)试管F中收集满气体后,下一步实验操作是 .

(1)A是制取CO2的装置.写出A中发生反应的化学方程式
(2)填写表中空格
| 仪器 | 加入试剂 | 加入试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D |
(4)试管F中收集满气体后,下一步实验操作是
考点:碱金属及其化合物的性质实验
专题:实验题
分析:由实验装置可知,本实验首先由CaCO3和盐酸反应生成CO2,产生气体通过饱和NaHCO3溶液,以除去CO2气体中混入的HCl,然后过氧化钠与CO2和水气反应,产生O2,用排水法收集O2,最后取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气.
解答:
解:(1)A为由CaCO3和盐酸反应生成CO2,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,
故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)产生气体通过饱和NaHCO3溶液,以除去CO2气体中混入的HCl,然后过氧化钠与CO2和水气反应,产生O2,由于生成的氧气中混有二氧化碳气体,应用NaOH溶液洗气,吸收未反应的CO2气体,用排水法收集O2,
故答案为:
(3)过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(4)本实验的目的为证明过氧化钠可作供氧剂,收集气体后要验证是否为氧气,为防止倒吸,应先把E中的导管移出水面,然后关闭分液漏斗活塞,用带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气,
故答案为:把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气.
故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)产生气体通过饱和NaHCO3溶液,以除去CO2气体中混入的HCl,然后过氧化钠与CO2和水气反应,产生O2,由于生成的氧气中混有二氧化碳气体,应用NaOH溶液洗气,吸收未反应的CO2气体,用排水法收集O2,
故答案为:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去CO2气体中混入的HCl |
| C | 过氧化钠 | 与CO2和水气反应,产生O2 |
| D | NaOH溶液 | 吸收未反应的CO2气体 |
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(4)本实验的目的为证明过氧化钠可作供氧剂,收集气体后要验证是否为氧气,为防止倒吸,应先把E中的导管移出水面,然后关闭分液漏斗活塞,用带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气,
故答案为:把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气.
点评:本题考查过氧化钠的性质的实验设计,题目难度不大,解答本题注意把握实验原理和相关实验的基本操作,注意除杂的先后顺序和检验氧气的操作方法.

练习册系列答案
相关题目
25℃某气态烃与氧气混合充入密闭容器中,点火爆炸后又恢复到25℃,此时容器内压强为开始时的一半,再经氢氧化钠溶液处理,容器内几乎为真空,该烃的分子式为( )
| A、C2H4 |
| B、C3H6 |
| C、C2H6 |
| D、C5H12 |
在下列化学反应中,既有离子键、极性键断裂,又有离子键、极性键形成的是( )
| A、Na2O+H2O═2NaOH |
| B、SO2+H2O═H2SO3 |
| C、Cl2+H2O═HCl+HClO |
| D、4Li+O2═2Li2O |
 如图是恒温下化学反应“A(g)+B(g)?C(g)”的反应速率随反应时间变化的示意图,下列叙述与示意图符合的是( )
如图是恒温下化学反应“A(g)+B(g)?C(g)”的反应速率随反应时间变化的示意图,下列叙述与示意图符合的是( )| A、平衡态Ⅰ与平衡态Ⅱ的正反应速率相等 |
| B、平衡移动的原因可能是增大了反应物浓度 |
| C、平衡移动的原因可能是增大了压强 |
| D、平衡状态Ⅰ和平衡状态Ⅱ的平衡常数的大小关系为K1<K2 |
 原子序数依次增大的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期.已知X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼铁;Z与X同主族,其单质在同周期元素中形成的单质中熔点最高;W原子核外的未成对电子数是前四周期元素中最多的.请回答下列问题:
原子序数依次增大的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期.已知X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼铁;Z与X同主族,其单质在同周期元素中形成的单质中熔点最高;W原子核外的未成对电子数是前四周期元素中最多的.请回答下列问题: