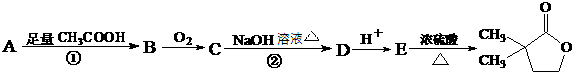
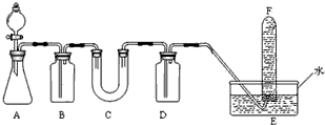
题目内容
已知有物质A、氨气,B、NaOH,C、食盐水,D、H2SO4,E、H2CO3,F、BaSO4,G、AgCl,H、Al(OH)3,I、CH3CH2OH,J、铜丝,K、CO2以上物质中:
(1)属于强电解质的是 .
(2)属于弱电解质的是 .
(3)属于非电解质的是 .
(4)既不属于电解质,由不属于非电解质的是 .
(5)写出物质G在溶液里的电离方程式 .
(1)属于强电解质的是
(2)属于弱电解质的是
(3)属于非电解质的是
(4)既不属于电解质,由不属于非电解质的是
(5)写出物质G在溶液里的电离方程式
考点:强电解质和弱电解质的概念,电解质与非电解质
专题:电离平衡与溶液的pH专题
分析:在水溶液或熔融状态下能够导电的化合物为电解质;
在水溶液和熔融状态下都不能导电的化合物为非电解质,包含大多数有机物、非金属氧化物、氨气;
在水溶液中能够完全电离的化合物为强电解质,包含强酸、强碱、大多数盐、活泼金属氧化物;
部分电离的为弱电解质,包含弱酸、弱碱、水;
单质和混合物既不是电解质,也不是非电解质,据此进行判断;
氯化银为强电解质,完全电离生成银离子、氯离子用等号.
在水溶液和熔融状态下都不能导电的化合物为非电解质,包含大多数有机物、非金属氧化物、氨气;
在水溶液中能够完全电离的化合物为强电解质,包含强酸、强碱、大多数盐、活泼金属氧化物;
部分电离的为弱电解质,包含弱酸、弱碱、水;
单质和混合物既不是电解质,也不是非电解质,据此进行判断;
氯化银为强电解质,完全电离生成银离子、氯离子用等号.
解答:
解:(1)B、NaOH属于强碱,D、H2SO4属于强酸,F、BaSO4属于盐,G、AgCl属于盐,在水溶液或熔融状态下能够完全电离出自由移动离子而导电,都是化合物,属于强电解质;
故答案为:BDFG;
(2)E、H2CO3是弱酸,H、Al(OH)3是弱碱,在水溶液或熔融状态下只能部分发生电离,属于弱电解质;
故答案为:EH;
(3)A、氨气,I、CH3CH2OH为有机物,K、CO2是非金属氧化物,在水溶液和熔融状态下都不能导电,属于非电解质;
故答案为:AIK;
(4)C、食盐水属于混合物,J、铜丝属于单质,既不是电解质也不是非电解质;
故答案为:CJ;
(5)氯化银为强电解质,完全电离产生银离子和氯离子,电离方程式为:AgCl=Ag++Cl-;
故答案为:AgCl=Ag++Cl-.
故答案为:BDFG;
(2)E、H2CO3是弱酸,H、Al(OH)3是弱碱,在水溶液或熔融状态下只能部分发生电离,属于弱电解质;
故答案为:EH;
(3)A、氨气,I、CH3CH2OH为有机物,K、CO2是非金属氧化物,在水溶液和熔融状态下都不能导电,属于非电解质;
故答案为:AIK;
(4)C、食盐水属于混合物,J、铜丝属于单质,既不是电解质也不是非电解质;
故答案为:CJ;
(5)氯化银为强电解质,完全电离产生银离子和氯离子,电离方程式为:AgCl=Ag++Cl-;
故答案为:AgCl=Ag++Cl-.
点评:本题主要考查电解质的概念、电离方程式的书写,注意电解质和非电解质都必须是化合物,强电解质完全电离,题目简单/

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
对于某些离子的检验及结论一定正确的是( )
A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO
| ||
B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO
| ||
C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,不一定有NH
| ||
| D、向待测液中加入KSCN溶液无现象,加入氯水后变为血红色,则待测液中含有Fe2+ |