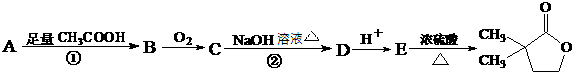
题目内容
 原子序数依次增大的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期.已知X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼铁;Z与X同主族,其单质在同周期元素中形成的单质中熔点最高;W原子核外的未成对电子数是前四周期元素中最多的.请回答下列问题:
原子序数依次增大的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期.已知X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼铁;Z与X同主族,其单质在同周期元素中形成的单质中熔点最高;W原子核外的未成对电子数是前四周期元素中最多的.请回答下列问题:(1)X、Y、Z三种元素的电负性由大到小的顺序为
(2)X、Y分别与H形成的化学键的极性关系为X-H
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测Z元素的电离能突增最早应出现在第
(4)用轨道式表示W基态原子的价层电子排布
(5)化合物XY2的熔点远低于ZY2,其理由是
(6)如图是化合物XY2的晶胞图,每一个XY2周围距离最近且相等的XY2有
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X的最外层电子数是其内层电子数的2倍,则X为碳元素,X与Y形成的常见化合物之一常被用于高炉炼铁,且X、Y同周期,所以Y为氧元素,Z与X同主族,其单质在同周期元素中形成的单质中熔点最高,则Z为硅元素,W原子核外的未成对电子数是前四周期元素中最多的,则W的外围电子排布式为3d54s1,所以W为铬元素,据此答题.
解答:
解:X的最外层电子数是其内层电子数的2倍,则X为碳元素,X与Y形成的常见化合物之一常被用于高炉炼铁,且X、Y同周期,所以Y为氧元素,Z与X同主族,其单质在同周期元素中形成的单质中熔点最高,则Z为硅元素,W原子核外的未成对电子数是前四周期元素中最多的,则W的外围电子排布式为3d54s1,所以W为铬元素,
(1)X、Y、Z分别为C、O、Si,根据元素周期律,同主族从上到下,元素的电负性逐渐减弱,原子半径增大,同周期从左到右,元素的电负性逐渐增大,原子半径逐渐减小,所以三种元素的电负性由大到小的顺序为O>C>Si,原子半径由大到小的顺序为Si>C>O,故答案为:O>C>Si;Si>C>O;
(2)由于O的电负性大于C,所以C-H键的极性小于O-H键,化合物C2H4O2的结构简式为CH3COOH,除了一个碳氧双键外,其它都是单键,所以一共有7个σ键和1个π键,
故答案为:<;7;1;
(3)Z为硅元素,其基态原子的核外电子排布式为1s22s22p63s23p2,第三能层4个电子能量相差不是很大,与第二能层的电子能量相差较大,故其电离能突增应出现在第五电离能,故答案为:五;
(4)W为铬元素,价层电子数6,其轨道式为 ,故答案为:
,故答案为: ;
;
(5)化合物XY2为CO2,是分子晶体,分子之间的作用力为分子间作用力,ZY2为SiO2是原子晶体,原子之间是共价键,分子间作用力远小于共价键,所以CO2的熔点远低于SiO2,故答案为:CO2是分子晶体,SiO2是原子晶体;
(6)根据晶胞结构图可知,以顶点上的CO2分子为例,距离最近且相等的CO2分布在晶胞的面心上,这样的面有12个,所以这样的分子也有12个,故答案为:12.
(1)X、Y、Z分别为C、O、Si,根据元素周期律,同主族从上到下,元素的电负性逐渐减弱,原子半径增大,同周期从左到右,元素的电负性逐渐增大,原子半径逐渐减小,所以三种元素的电负性由大到小的顺序为O>C>Si,原子半径由大到小的顺序为Si>C>O,故答案为:O>C>Si;Si>C>O;
(2)由于O的电负性大于C,所以C-H键的极性小于O-H键,化合物C2H4O2的结构简式为CH3COOH,除了一个碳氧双键外,其它都是单键,所以一共有7个σ键和1个π键,
故答案为:<;7;1;
(3)Z为硅元素,其基态原子的核外电子排布式为1s22s22p63s23p2,第三能层4个电子能量相差不是很大,与第二能层的电子能量相差较大,故其电离能突增应出现在第五电离能,故答案为:五;
(4)W为铬元素,价层电子数6,其轨道式为
 ,故答案为:
,故答案为: ;
;(5)化合物XY2为CO2,是分子晶体,分子之间的作用力为分子间作用力,ZY2为SiO2是原子晶体,原子之间是共价键,分子间作用力远小于共价键,所以CO2的熔点远低于SiO2,故答案为:CO2是分子晶体,SiO2是原子晶体;
(6)根据晶胞结构图可知,以顶点上的CO2分子为例,距离最近且相等的CO2分布在晶胞的面心上,这样的面有12个,所以这样的分子也有12个,故答案为:12.
点评:本题主要考查了碳族元素的有关知识,难度不大,解题时注意要熟练运用常见的物质结构的知识.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
某同学在做中和热的测定实验时,有些操作不规范,造成测得中和热的数值偏高,请你分析可能的原因( )
| A、测量盐酸的温度后,温度计没有用水冲洗干净 |
| B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 |
| C、量取盐酸时仰视读数 |
| D、将50 mL 0.55 mol/L氢氧化钠溶液取成了50 mL0.55 mol/L的氨水 |