题目内容
25℃某气态烃与氧气混合充入密闭容器中,点火爆炸后又恢复到25℃,此时容器内压强为开始时的一半,再经氢氧化钠溶液处理,容器内几乎为真空,该烃的分子式为( )
| A、C2H4 |
| B、C3H6 |
| C、C2H6 |
| D、C5H12 |
考点:有关有机物分子式确定的计算
专题:计算题
分析:经氢氧化钠溶液处理后,容器内几乎变为真空,说明气态烷烃和氧气完全反应,设烷烃的分子式为CnH2n+2,点燃爆炸后,又恢复到起始温度,此时容器内的压强减至原压强的一半,剩余气体为CO2,生成的二氧化碳的分子物质的量是烃与氧气总物质的量的一半,根据燃烧的通式进行计算.
解答:
解:烃燃烧后的气体经NaOH溶液吸收,容器几乎成真空,说明烃和O2完全反应生成CO2和液态水,
设此碳氢化合物的化学式为CxHy,则有
4CxHy+(4x+y)O2
4xCO2+2yH2O(l)
根据题意可知4+4x+y=2×4x,
由此可得:4x=4+y
若x=1,则y=0,不存在此物质,
若x=2,则y=4,物质为C2H4,
若x=3,则y=8,物质为C3H8,
气态烃碳原子数小于5,
故选A.
设此碳氢化合物的化学式为CxHy,则有
4CxHy+(4x+y)O2
| 点燃 |
根据题意可知4+4x+y=2×4x,
由此可得:4x=4+y
若x=1,则y=0,不存在此物质,
若x=2,则y=4,物质为C2H4,
若x=3,则y=8,物质为C3H8,
气态烃碳原子数小于5,
故选A.
点评:本体考查有机物的推断,题目难度中等,明确反应前后压强的变化是解答该题的关键,易错点为根据燃烧的进行计算,注意体会.

练习册系列答案
相关题目
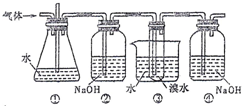 如图是用实验室制得的乙烯(C2H5OH
如图是用实验室制得的乙烯(C2H5OH | 浓硫酸 |
| 170℃ |
| A、装置①和装置③中都盛有水,其作用相同 |
| B、装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同 |
| C、产物可用分液的方法进行分离,1,2-二溴乙烷应从分液漏斗的上口倒出 |
| D、制备乙烯和生成1,2-二溴乙烷的反应类型分别是消去反应和加成反应 |
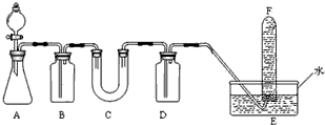
 已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;
已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;
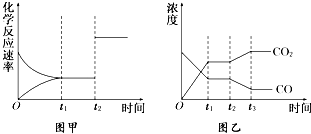
 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是