题目内容
CaO循环吸收CO2法是一种常用的技术,在降低温室气体CO2排放中具有重要的作用,其原理为CaO先与CO2反应生成CaCO3,反应一段时间后,对生成的CaCO3加热使其分解生成CaO,然后再利用生成CaO来吸收CO2,如此循环下去.某研究小组在体积相同的密闭容器中,各充入28gCaO和足量含CO2的混合气体(其他成分不与CaO反应)研究得温度和颗粒直径对CaO吸收CO2活性(即CaO转化率X)的影响如图所示.依据以上信息,回答下列问题:
(1)反应CaO(s)+CO2(g)?CaCO3(s)的△H 0,△S 0(填“<”、“>”或“=”),可以判断该反应已经达到平衡的是
A.密闭容器中总压强不变
B.密闭容器中CO2的体积分数不变
C.密闭容器中固体质量不变
D.消耗5.6gCaO的同时生成10.0gCaCO2
(2)743℃时,CaO转化率X显著下降的原因是 ,CaO吸收CO2反应最适合的温度为
(3)若用单位时间内密闭容器中固体质量增重量来表示反应速率,则颗粒粒径为20μm的CaO从反映开始至5分钟时平均速率为 .
(4)实验表明CaO吸收CO2的活性随循环次数增多而降低,结合题给信息分析其原因是 .
(5)反应气体中CO2的体积分数φ(CO2)对CaO吸收CO2特性也有一定的影响,请在如图2中画出φ(CO2)=25%时反应转化率的变化趋势.

(1)反应CaO(s)+CO2(g)?CaCO3(s)的△H
A.密闭容器中总压强不变
B.密闭容器中CO2的体积分数不变
C.密闭容器中固体质量不变
D.消耗5.6gCaO的同时生成10.0gCaCO2
(2)743℃时,CaO转化率X显著下降的原因是
(3)若用单位时间内密闭容器中固体质量增重量来表示反应速率,则颗粒粒径为20μm的CaO从反映开始至5分钟时平均速率为
(4)实验表明CaO吸收CO2的活性随循环次数增多而降低,结合题给信息分析其原因是
(5)反应气体中CO2的体积分数φ(CO2)对CaO吸收CO2特性也有一定的影响,请在如图2中画出φ(CO2)=25%时反应转化率的变化趋势.
考点:化学平衡状态的判断,反应速率的定量表示方法,化学平衡的影响因素
专题:化学平衡专题
分析:(1)据△H-T△S<0的反应能够自发进行判断;正反应是气体体积减小的反应;平衡状态是指各组分浓度保持不变正逆反应速率相等的状态;
(2)正反应放热,升温时平衡逆向移动;据图象分析,690℃-720℃时,CaO转化率的斜率最大且转化率增大;
(3)据化学方程式,计算反应的CaO的质量,从而计算二氧化碳的质量,即为固体增重质量,再据v=
计算;
(4)CaO吸收CO2时,随循环次数增多,生成的碳酸钙增多,固体颗粒直径变大,表面积变大,结合图1分析;
(5)CO2的体积分数越大,越有利于CaO吸收,据此画图.
(2)正反应放热,升温时平衡逆向移动;据图象分析,690℃-720℃时,CaO转化率的斜率最大且转化率增大;
(3)据化学方程式,计算反应的CaO的质量,从而计算二氧化碳的质量,即为固体增重质量,再据v=
| △m |
| △t |
(4)CaO吸收CO2时,随循环次数增多,生成的碳酸钙增多,固体颗粒直径变大,表面积变大,结合图1分析;
(5)CO2的体积分数越大,越有利于CaO吸收,据此画图.
解答:
解:(1)正反应是气体体积减小的反应,△S<0,反应能够自发进行,必须△H-T△S<0,所以△H必须小于0;平衡状态是指各组分浓度保持不变正逆反应速率相等的状态,
A、压强不变,说明二氧化碳的量不再发生改变,反应达到平衡状态,故A正确;
B、密闭容器中CO2的体积分数不变,说明二氧化碳的量不再发生改变,反应达到平衡状态,故B正确;
C、密闭容器中固体质量不变,说明气体二氧化碳的量不再发生改变,反应达到平衡状态,故C正确;
D、消耗5.6gCaO的同时生成10.0gCaCO3,都是反应正向进行,不能说明反应达到平衡状态,故D正确;
故答案为:<;<;ABC;
(2)正反应放热,升温时平衡逆向移动,所以743℃时CaO转化率X显著下降;据图象分析,690℃-720℃时,CaO转化率的斜率最大且转化率增大,故答案为:正反应放热,升温时平衡逆向移动;690℃;690℃-720℃;
(3)5min时,CaO的转化率为60%,则反应的CaO为28g×0.6=16.8g,则参加反应的二氧化碳的质量为:
=13.2g,固体的反应速率应为v=
=
=2.64g/min,故答案为:2.64g/min;
(4)CaO吸收CO2时,随循环次数增多,生成的碳酸钙增多,固体颗粒直径变大,表面积变大,据图1可知,颗粒粒径越大,CaO转化率越低,故答案为:多次循环后CaO的颗粒直径增大;
(5)CO2的体积分数越大,越有利于CaO吸收,图象斜率变大,图象为: ,故答案为:
,故答案为: .
.
A、压强不变,说明二氧化碳的量不再发生改变,反应达到平衡状态,故A正确;
B、密闭容器中CO2的体积分数不变,说明二氧化碳的量不再发生改变,反应达到平衡状态,故B正确;
C、密闭容器中固体质量不变,说明气体二氧化碳的量不再发生改变,反应达到平衡状态,故C正确;
D、消耗5.6gCaO的同时生成10.0gCaCO3,都是反应正向进行,不能说明反应达到平衡状态,故D正确;
故答案为:<;<;ABC;
(2)正反应放热,升温时平衡逆向移动,所以743℃时CaO转化率X显著下降;据图象分析,690℃-720℃时,CaO转化率的斜率最大且转化率增大,故答案为:正反应放热,升温时平衡逆向移动;690℃;690℃-720℃;
(3)5min时,CaO的转化率为60%,则反应的CaO为28g×0.6=16.8g,则参加反应的二氧化碳的质量为:
| 16.8×44 |
| 56 |
| △m |
| △t |
| 13.2g |
| 5min |
(4)CaO吸收CO2时,随循环次数增多,生成的碳酸钙增多,固体颗粒直径变大,表面积变大,据图1可知,颗粒粒径越大,CaO转化率越低,故答案为:多次循环后CaO的颗粒直径增大;
(5)CO2的体积分数越大,越有利于CaO吸收,图象斜率变大,图象为:
 ,故答案为:
,故答案为: .
.
点评:本题考查了反应自发进行与熵变焓变的关系、化学平衡状态的判断、图象分析,题目难度中等.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
今有一混合物的水溶液,可能大量含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下针对原溶液的推测正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下针对原溶液的推测正确的是( )
| A、Cl-一定不存在 |
| B、K+一定存在 |
| C、Mg2+一定存在 |
| D、Ba2+可能存在 |
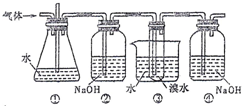 如图是用实验室制得的乙烯(C2H5OH
如图是用实验室制得的乙烯(C2H5OH | 浓硫酸 |
| 170℃ |
| A、装置①和装置③中都盛有水,其作用相同 |
| B、装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同 |
| C、产物可用分液的方法进行分离,1,2-二溴乙烷应从分液漏斗的上口倒出 |
| D、制备乙烯和生成1,2-二溴乙烷的反应类型分别是消去反应和加成反应 |



 工业上合成合成氨的热化学方程式如下:
工业上合成合成氨的热化学方程式如下: