题目内容
1.X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻,X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物M2Y.下列说法正确的是( )| A. | 原子半径:M>Z>Y | |
| B. | Z元素的最高价氧化物的水化物的化学式为HZO4 | |
| C. | M2Y2中阴离子与阳离子的个数比为1:1 | |
| D. | X的氢化物的沸点低于Y的氢化物的沸点 |
分析 X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻,X的核电荷数是Y是核外电子数的一半,可知X为O,Y为S,则Z为Cl,Y与M可形成化合物M2Y,则M为Ca,以此来解答.
解答 解:由上述分析可知,X为O,Y为S,Z为Cl,M为Ca,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:M>Y>Z,故A错误;
B.Z元素为Cl,最高价为+7价,最高价氧化物的水化物的化学式为HZO4,故B正确;
C.Ca2S2中阴离子与阳离子的个数比为1:2,故C错误;
D.水分子间含氢键,X的氢化物的沸点高于Y的氢化物的沸点,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子序数推断元素为解答的关键,侧重分析与应用能力的考查,注意X为O、Y为S为突破口,题目难度不大.

练习册系列答案
相关题目
12.从柑橘中提炼得结构式为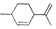 的化合物,则下列有关它的推断错误的是( )
的化合物,则下列有关它的推断错误的是( )
 的化合物,则下列有关它的推断错误的是( )
的化合物,则下列有关它的推断错误的是( )| A. | 分子式为C10H16 | B. | 其一氯代物有9种 | ||
| C. | 常温下呈固态,比水重 | D. | 能与溴水发生加成反应 |
16.在下列变化过程中,没有破坏化学键的是( )
| A. | 将食盐加热融化 | B. | 将蔗糖溶于水中 | ||
| C. | 将NO2溶于水中 | D. | 将氢气和氯气混合后光照反应 |
6.下列说法正确的是( )
| A. | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体,结论:HNO3分解成了NO2 | |
| B. | 浓硫酸具有吸水性,因而能使蔗糖碳化 | |
| C. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色 | |
| D. | NH3和NO2在一定条件下可发生氧化还原反应 |
10.根据下列有关实验得出的结论一定正确的是( )
| 选项 | 实验 | 结论 |
| A | 相同温度下,向盛有足量稀硫酸的甲、乙两只试管中分别加入等质量的锌粒,并向甲中加入少量胆矾固体 | 产生氢气的速率和体积:甲>乙 |
| B | 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液,溶液变黄 | 氧化性:H2O2>Fe3+ |
| C | 相同温度下,将等质量的大理石块和大理石粉分别加入到等体积、等浓度的盐酸中 | 反应速率:粉状大理石>块状大理石 |
| D | 向2mL0.1mol•L-1Na2S溶液中滴入几滴0.1mol•L-1ZnSO4溶液,生成白色沉淀;再加入几滴0.1mol•L-1CuSO4溶液,又产生黑色沉淀 | 溶度积:KSP(ZnS)>KSP(CuS) |
| A. | A | B. | B | C. | C | D. | D |
15.无色溶液中可以大量共存的是( )
| A. | Fe3+、Cl-、Na+、SO42- | B. | MnO4-、K+、Cl-、Na+ | ||
| C. | NH4+、SO42-、OH-、Na+ | D. | CO32-、HCO3-、K+、Na+ |