题目内容
16.在下列变化过程中,没有破坏化学键的是( )| A. | 将食盐加热融化 | B. | 将蔗糖溶于水中 | ||
| C. | 将NO2溶于水中 | D. | 将氢气和氯气混合后光照反应 |
分析 化学变化中化学键一定被破坏,共价化合物或离子化合物电离时化学键被破坏,以此来解答.
解答 解:A.食盐熔化,离子键破坏,故A不选;
B.蔗糖属于非电解质,在水溶液中不电离也不发生化学反应,只破坏分子间作用力,化学键一定没有破坏,故B选;
C.将NO2溶于水中,与水反应生成硝酸和NO,化学键一定被破坏,故C不选;
D.将氢气和氯气混合后光照反应,发生化学反应,化学键一定被破坏,故D不选;
故选B.
点评 本题考查化学键,为高频考点,把握变化过程中化学键是否变化为解答的关键,注意分子晶体的三态变化只破坏分子间作用力,题目难度不大.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
4.下列叙述中正确的是( )
| A. | 原电池的负极发生还原反应 | |
| B. | 电化学反应的实质是金属单质失去电子形成阳离子,而电子直接给氧化剂 | |
| C. | 金属在潮湿环境中主要发生析氢腐蚀 | |
| D. | 铜铁在潮湿的中性环境中锈蚀时,开始有Fe(OH)2,而后逐渐变成Fe(OH)3和Fe2O3 |
11.下列有关粒子的表示方法正确的是( )
| A. | CO2的结构式:O=C=O | B. | CH4的球棍模型: | ||
| C. | H2O的电子式: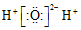 | D. | C2H4的结构简式:CH2=CH2 |
1.X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻,X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物M2Y.下列说法正确的是( )
| A. | 原子半径:M>Z>Y | |
| B. | Z元素的最高价氧化物的水化物的化学式为HZO4 | |
| C. | M2Y2中阴离子与阳离子的个数比为1:1 | |
| D. | X的氢化物的沸点低于Y的氢化物的沸点 |
8.请按要求填写下列空白:
(1)写出含有10e-且呈正四面体结构的分子的名称甲烷;
(2)写出含有16e-的烃分子的电子式 ;
;
(3)写出含有18e-常温下呈液态且具有强氧化性的分子的结构式H-O-O-H.
(1)写出含有10e-且呈正四面体结构的分子的名称甲烷;
(2)写出含有16e-的烃分子的电子式
 ;
;(3)写出含有18e-常温下呈液态且具有强氧化性的分子的结构式H-O-O-H.
5.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 能与铝反应放出氢气的溶液中:K+、SO42-、NO3-、NH4+ | |
| C. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3- |
10.如图是进行电化学实验的两个装置,下列有关说法正确的是( )

| A. | 甲装置中有沉淀生成,乙装置中Mg电极上有气泡生成 | |
| B. | 反应后,甲装置中溶液的质量增大,乙装置中溶液的质量减小 | |
| C. | 电极反应式:甲中阳极Fe-2e-=Fe2+,乙中负极Mg-2e-=Mg2+ | |
| D. | 反应后甲中溶液的pH减小,乙中溶液的pH增大 |