��Ŀ����
11�����н�������A������ס��ҡ���������B��C��D��E��F��G������֮���ܷ�����ͼ��Ӧ��ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ���������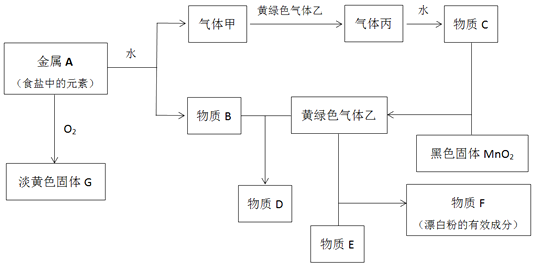
�����������Ϣ�ش��������⣺
��1��ʵ������ȡ�����Ļ�ѧ����ʽΪ4HCl��Ũ��+MnO2 $\frac{\underline{\;\;��\;\;}}{\;}$ Cl2��+MnCl2+2H2O��
MnO2 ���������������Ӧ�����������ڱ�������Ϊ2.24L����������HCl�����ʵ�����2mol
��2��д�����з�Ӧ�����ӷ���ʽ��
�ٽ���A��ˮ2Na+2H2O=2Na++2OH-+H2��
������B��������2OH-+Cl2=Cl-+ClO-+H2O
��3����������ѧ����ʽ��ʾ����G��������ϵͳ������ԭ��2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2��
��4���û�ѧ����ʽ����F���ڷ����ڿ�����ʧЧ��ԭ��Ca��ClO��2+H2O+CO2=CaCO3+2HClO��2HClO$\frac{\underline{\;����\;}}{\;}$2HCl+O2��
��5������ϸ��˿���������Ҿ���ȼ�գ������Dz����غ�ɫ���̽�ȼ�ղ�����ɱ�����Һ�����ˮ�п��Եõ��������������壬������������������ֱ����1-100nm
֮�䣮���������������е������ϡ���ᣬ�������Ȳ������ɫ��������ܽ�Ϊ��ɫ��Һ��
���� ����AΪʳ���е�Ԫ�أ�ӦΪNa����������Ӧ���ɵ�GΪNa2O2����ת����ϵ��֪��ΪH2������ɫ������ΪCl2����ΪHCl��CΪ���ᣬBΪNaOH������D����NaCl��NaClO��FΪƯ�۵���Ч�ɷ֣���ӦΪCa��ClO��2��EΪCaCl2���Դ˽����⣮
��� �⣺��1����Ӧ��MnԪ�ػ��ϼ۽��ͣ�����ԭ�����������Ϊ�������������Ӧ�����������ڱ�������Ϊ2.24L��������1mol��������Ӧ��ClԪ�ػ��ϼ���-1�����ߵ�0�ۣ�����2molHCl��������
�ʴ�Ϊ�������� 2��
��2�����ƺ�ˮ��Ӧ�����������ƺ�����������ʽΪ2Na+2H2O=2Na++2OH-+H2�����ʴ�Ϊ��2Na+2H2O=2Na++2OH-+H2����
���������ƺ�������Ӧ�����Ȼ��ơ��������ƺ�ˮ������ʽΪ2OH-+Cl2=Cl-+ClO-+H2O���ʴ�Ϊ��2OH-+Cl2=Cl-+ClO-+H2O��
��3���������ƿ���ˮ��������̼��Ӧ����������������������������ʽΪ2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2����
�ʴ�Ϊ��2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2����
��4��Ư�۵���Ҫ�ɷ�ΪCaCl2��Ca��ClO��2������¶�ÿ�����ʱ���������ˮ��������̼��Ӧ����̼��ƺ�HClO��HClO�ֽ⣬�Ӷ����ʣ���������ʱ�����ķ�ӦΪCa��ClO��2+H2O+CO2=CaCO3+2HClO��2HClO$\frac{\underline{\;����\;}}{\;}$2HCl+O2����
�ʴ�Ϊ��Ca��ClO��2+H2O+CO2=CaCO3+2HClO��2HClO$\frac{\underline{\;����\;}}{\;}$2HCl+O2����
��5������������ȼ�������Ȼ������ɹ۲쵽�����غ�ɫ���̣���������ֱ������ 1-100nm�����������������м������ᣬ���巢���۳���Ȼ������������Һ���ᣬ�ɹ۲쵽�Ȳ������ɫ��������ܽ�Ϊ��ɫ��Һ��
�ʴ�Ϊ�������غ�ɫ���̣�1-100nm�� �Ȳ������ɫ��������ܽ�Ϊ��ɫ��Һ��
���� ����������ͼ�����ʽ����Na��Cl��Ԫ�ص��ʼ��仯����֮����ת����ϵ��Ϊ�߿��������ͣ����ؿ���ѧ���ķ���������ע����ջ�ѧʽ����д�����ӷ���ʽ�ȣ��Ѷ��еȣ�ע�����֪ʶ�����գ�

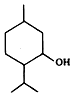
| A�� | ���ɴ����ڷ������ĺ��������� | |
| B�� | ���ɴ�����ʽΪC10H20O�����ǻ�������ͬϵ�� | |
| C�� | ���ɴ����ϵ�һ��ȡ����ֻ������ | |
| D�� | ��һ�������£����ɴ�������������ˮ��Ӧ |
| ʵ����� | I | II | III |
| ���������mL�� | 50.0 | 50.0 | 50.0 |
| ��Ʒ����/g | 9.2 | 15.7 | 27.6 |
| CO2���/L ����״���� | 2.24 | 3.36 | 3.36 |
��2����III��ʵ�����NaHCO3�����ʵ���Ϊ0.075mol��
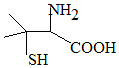 �iù��������Ҫ�Ŀ����أ��������ھ�����ˮ���õ�һ���л���X����֪X�Ľṹ��ͼ�������й�X��˵����ȷ���ǣ�������
�iù��������Ҫ�Ŀ����أ��������ھ�����ˮ���õ�һ���л���X����֪X�Ľṹ��ͼ�������й�X��˵����ȷ���ǣ�������| A�� | XΪ���ĺ��������� | |
| B�� | X�ķ���ʽΪC5H10NO2S | |
| C�� | Xֻ�ܷ���ȡ����Ӧ | |
| D�� | X��̼ԭ���ϵ�H����1����Clȡ������2�ֲ�ͬ���� |
| A�� | KClO3��KCI | B�� | HNO3��NO | C�� | Mn2+��Mn04- | D�� | Fe3+��Fe2+ |
| A�� | �����ܶ�С���۵�ϵ� | |
| B�� | ���ڿ�����ȼ�գ��ų��������� | |
| C�� | ���ڽ������˳������ڽ�ǰ�� | |
| D�� | �����л�ԭ�ԣ�����������ԭ��Ӧʱ�ų��������� |
| A�� | ԭ�Ӻ�����2�����Ӳ� | B�� | ������Ӳ�����2������ | ||
| C�� | ��4He��1������ | D�� | ��4He�� 1������ |
| A�� | ԭ�Ӱ뾶��M��Z��Y | |
| B�� | ZԪ�ص�����������ˮ����Ļ�ѧʽΪHZO4 | |
| C�� | M2Y2���������������ӵĸ�����Ϊ1��1 | |
| D�� | X���⻯��ķе����Y���⻯��ķе� |