题目内容
15.无色溶液中可以大量共存的是( )| A. | Fe3+、Cl-、Na+、SO42- | B. | MnO4-、K+、Cl-、Na+ | ||
| C. | NH4+、SO42-、OH-、Na+ | D. | CO32-、HCO3-、K+、Na+ |
分析 根据离子之间不能结合生成沉淀、气体、水、弱电解质等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.Fe3+为黄色,与无色不符,故A不选;
B.MnO4-为紫色,与无色不符,故B不选;
C.NH4+、OH-结合生成弱碱,不能共存,故C不选;
D.该组离子之间不反应,可大量共存,且离子均为无色,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
相关题目
1.X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻,X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物M2Y.下列说法正确的是( )
| A. | 原子半径:M>Z>Y | |
| B. | Z元素的最高价氧化物的水化物的化学式为HZO4 | |
| C. | M2Y2中阴离子与阳离子的个数比为1:1 | |
| D. | X的氢化物的沸点低于Y的氢化物的沸点 |
2.常温下,下列说法正确的是( )
| A. | pH值都为4的稀盐酸和NH4Cl溶液中,水的电离程度相同 | |
| B. | 浓度均为0.1mol/L的醋酸和NaOH溶液等体积混合后:lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$]=0 | |
| C. | 在含浓度都为0.01mol/L的Cl-、CrO42-的混合溶液中滴加AgNO3溶液,先出现沉淀的是AgCl.[已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12] | |
| D. | 浓度均为0.1mol/L的NH4Cl和CH3COONH4溶液中,c(NH4+)相同 |
3.用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液的pH下降的是( )
| A. | CuSO4 | B. | BaCl2 | C. | NaNO3 | D. | H2SO4 |
10.如图是进行电化学实验的两个装置,下列有关说法正确的是( )

| A. | 甲装置中有沉淀生成,乙装置中Mg电极上有气泡生成 | |
| B. | 反应后,甲装置中溶液的质量增大,乙装置中溶液的质量减小 | |
| C. | 电极反应式:甲中阳极Fe-2e-=Fe2+,乙中负极Mg-2e-=Mg2+ | |
| D. | 反应后甲中溶液的pH减小,乙中溶液的pH增大 |
20.下列结晶水合物的名称或化学式错误的是( )
| A. | 胆矾:CuSO4•5H2O | B. | 明矾:KAl(SO4)2•12H2O | ||
| C. | 石碱:Na2CO3•10H2O | D. | 绿矾:Fe2(SO4)3•7H2O |
4.下列化学用语正确的是( )
| A. | 126C是指质子数是6、中子数是12的碳原子 | |
| B. | 醋酸的电离方程式为CH3COOH=CH3COO-+H+ | |
| C. | 钠原子的结构示意图为: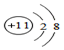 | |
| D. | 4020Ca和4220Ca 互为同位素 |
5.下列说法正确的是( )
| A. | 一定条件下,增加反应物的量,必定加快反应速率 | |
| B. | 升高温度正反应速率增大,逆反应速率也增大 | |
| C. | 可逆反应的特征是正反应速率总是和逆反应速率相等 | |
| D. | 增大压强一定会加快反应速率 |
