题目内容
1.图是中学教材中元素周期表的一部分,其中标出A~Q14种元素,试回答下列问题: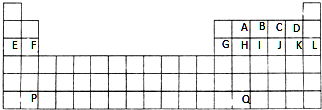
(1)在上表所列出的短周期元素中(填具体物质化学式)
①形成的气态氢化物最稳定的是HF;
②最高价氧化物对应的水化物中酸性最强的是HClO4.
③简单阳离子半径最小的是Al3+.
(2)用电子式表示F与K形成的化合物的形成过程
 .
.(3)F与K形成的化合物溶于水所克服的微粒间作用力为离子键.
(4)B元素形成的单质的结构式为N≡N,K形成简单离子的结构示意图为
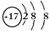 .
.(5)设P的原子序数为Z,则Q的原子序数为Z+26(用Z表示).
分析 由元素在周期表中位置,可知A为C元素、B为N元素、C为O、D为F、E为Na、F为Mg、G为Al、H为Si、I为P、J为S、K为Cl、L为Ar、P为Ba、Q为Pb,
(1)①同周期自左而右非金属性增强,同主族自上而下非金属性减弱;
②最高价氧化物对应的水化物中酸性最强的是高氯酸;
③电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(2)F与K形成的化合物为氯化镁,为离子化合物;
(3)F与K形成的化合物为MgCl2,属于离子化合物;
(4)B元素形成的单质为氮气,结构式为N≡N,K形成简单离子为Cl-,离子核外有18个电子,有3个电子层,各层电子数为2、8、8;
(5)P、Q处于第六周期,分别处于2、14列,相差12列,其中该周期第3列容纳15种元素,故Q的原子序数=Z+15+(12-1)=Z+26.
解答 解:由元素在周期表中位置,可知A为C元素、B为N元素、C为O、D为F、E为Na、F为Mg、G为Al、H为Si、I为P、J为S、K为Cl、L为Ar、P为Ba、Q为Pb,
(1)①同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故上述元素中F的非金属性最强,非金属性越强,氢化物越稳定,故HF最稳定,故答案为:HF;
②最高价氧化物对应的水化物中酸性最强的是高氯酸,化学式为HClO4,故答案为:HClO4;
③电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故上述元素形成的阳离子中Al3+半径最小,故答案为:Al3+;
(2)F与K形成的化合物为氯化镁,为离子化合物,电子式表示的形成过程为 ,
,
故答案为: ;
;
(3)F与K形成的化合物为MgCl2,属于离子化合物,微粒键作用力为离子键,溶于水所克服的微粒间作用力为离子键,故答案为:离子键;
(4)B元素形成的单质为氮气,结构式为N≡N,K形成简单离子为Cl-,离子核外有18个电子,有3个电子层,各层电子数为2、8、8,离子结构示意图为: ,故答案为:N≡N;
,故答案为:N≡N;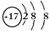 ;
;
(5)P、Q处于第六周期,分别处于2、14列,相差12列,其中该周期第3列容纳15种元素,故Q的原子序数=Z+15+(12-1)=Z+26,故答案为:Z+26.
点评 本题考查元素周期表与元素周期律,侧重对元素周期律与化学用语考查,注意理解掌握同族元素原子序数关系,掌握列与族的关系,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 硝基苯和酒精 | B. | 溴苯和溴 | C. | 甲苯和水 | D. | 硝基苯和己烷 |
| A. | r(Na)>r(Mg)>r(Al)>r(K) | B. | r(K+)>r(Ca2+)>r(S2-)>r(Cl-) | ||
| C. | r(Na)>r(K)>r(Ca)>r(Mg) | D. | r(F-)>r(Na+)>r(Mg2+)>r(Al3+) |
 1-苯乙醇具有柔和、愉快而持久的玫瑰香气,广泛用于各种食用香精和烟用香精中.实验室以苯乙酮和硼氢化钠为原料制备1-苯乙醇的反应原理、装置和有关数据如下:
1-苯乙醇具有柔和、愉快而持久的玫瑰香气,广泛用于各种食用香精和烟用香精中.实验室以苯乙酮和硼氢化钠为原料制备1-苯乙醇的反应原理、装置和有关数据如下:| 试剂 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) | 溶解性 | ||
| 水 | 乙醇 | 乙醚 | ||||
| 1-苯乙醇 | 20 | 203.4 | 1.013 | 不溶 | 溶 | 溶 |
| 苯乙酮 | 19.7 | 202.3 | 1.028 | 不溶 | 溶 | 溶 |
| 硼氢化钠 | - | - | 1.076 | 溶 | 溶 | 不溶 |
| 乙醚 | -116.3 | 34.6 | 0.713 | 微溶 | 溶 | - |

实验步骤:
①在烧杯中加入15mL 95%的乙醇和0.1g硼氢化钠,搅拌下,再滴入8mL苯乙酮,控制温度在48℃~50℃,滴加完毕,室温下放置15min.
②在搅拌的条件下,慢慢滴加6mL 3mol/L的盐酸.
③水浴加热,使反应液中大部分乙醇蒸出,出现分层,再加入10mL乙醚.将混合反应液倒入分液漏斗,分离上述液体,水层再用10mL乙醚萃取,合并两次分液得到的有机相.
④加入适量无水硫酸镁,静置片刻,过滤除去硫酸镁固体.再加入0.6g无水碳酸钾,然后进行简单蒸馏除去乙醚.
⑤经减压蒸馏得到1-苯乙醇4.5g(减压蒸馏可降低有机物的沸点).
(1)反应中加入乙醇的目的是溶解硼氢化钠和苯乙酮,使反应物充分接触.
(2)反应完成后,蒸出大部分乙醇,反应液出现分层,上层为水层(填“水层”或“有机层”,下同),加入10mL乙醚,充分振荡后,上层为有机层.
(3)装置中仪器A的名称为蒸馏烧瓶,在本实验中最好选用的规格是50mL(填“50mL”、“100mL”或“200mL”);仪器B中冷凝水由a(填“a”或“b”)口流出.
(4)步骤④中加入无水硫酸镁的作用是干燥.
(5)步骤④蒸馏除去乙醚时,应采用的最佳加热方式为b(填字母序号)
a.酒精灯加热 b.水浴加热 c.油浴加热 d.酒精喷灯加热.
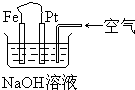
| A. | 这是电解NaOH溶液的装置 | |
| B. | Pt为正极,其电极反应为:O2+2H2O+4eˉ═4OHˉ | |
| C. | Fe为阳极,其电极反应为:Fe-2eˉ+2OHˉ═2Fe(OH)2 | |
| D. | 这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色 |
| A. | 向苯酚中加浓溴水观察沉淀 | |
| B. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| C. | 苯与浓溴水反应制取溴苯 | |
| D. | 1 mol•L-1 CuSO4溶液2 mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 |