题目内容
14.①铅蓄电池总反应为Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l).若该电池工作时,转移2mol电子,则负极的质量变化96克②用乙醇、浓氢氧化钠和空气形成的燃料电池,写出其负极的电极反应式:CH3CH2OH-12e-+16OH-=2CO32-+11H2O.
③写出碱性锌锰干电池的正极的电极反应为:MnO2+e-+H2O=MnOOH+OH-.
分析 ①放电时,负极发生氧化反应,Pb失去电子生成PbSO4,反应消耗硫酸,硫酸的浓度减小,负极得到PbSO4,负极板增重质量为负极生成PbSO4的质量的中硫酸根离子质量,根据电子转移守恒计算;
②乙醇在负极发生氧化反应生成碳酸根离子和水;
③碱性锌锰干电池中正极上MnO得电子生成MnOOH.
解答 解:①放电时,负极发生氧化反应,Pb失去电子生成PbSO4,负极电极反应式为:Pb+SO42--2e-=PbSO4,反应消耗硫酸,电解液中H2SO4的浓度将变小,负极板增重质量为负极生成PbSO4的质量的中硫酸根离子质量,
负极参加反应硫酸根为$\frac{2mol}{2}$=1mol,则负极板质量增重为1mol×96g/mol=96g,
故答案为:96;
②乙醇在负极发生氧化反应生成碳酸根离子和水,离子方程式为:C2H6O+16OH--12e-=2CO32-+11H2O,
故答案为:C2H6O+16OH--12e-=2CO32-+11H2O;
③碱性锌锰干电池中正极上MnO得电子生成MnOOH,其电极方程式为:MnO2+e-+H2O=MnOOH+OH-;
故答案为:MnO2+e-+H2O=MnOOH+OH-.
点评 本题考查原电池与电解工作原理,关键是明确电极发生反应以及电极方程式的书写方法,注意掌握电极判断方法,难度不大,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
3.下列有关实验说法中,正确的是( )
| A. | 用浓硝酸做试剂比较铁和铜的金属活动性 | |
| B. | 使用干燥洁净玻璃棒将氯水滴在干燥pH试纸上,测定氯水的pH | |
| C. | 欲检验Br-的存在,可在溶液中先加入氯水、再加入CCl4,振荡、静置,观察下层溶液显橙红色 | |
| D. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电荷 |
 ,含有离子键和非极性共价键的化合物的电子式为
,含有离子键和非极性共价键的化合物的电子式为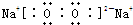 ;含有极性共价键和非极性共价键的化合物的电子式为
;含有极性共价键和非极性共价键的化合物的电子式为 .
. .
.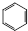 +HNO3$\stackrel{催化剂}{→}$
+HNO3$\stackrel{催化剂}{→}$ +H2O,反应类型取代反应
+H2O,反应类型取代反应 如图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液中S2-浓度,金属阳离子浓度变化情况.如果向含有这三种沉淀的混合物中加盐酸,最先溶解的是FeS.
如图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液中S2-浓度,金属阳离子浓度变化情况.如果向含有这三种沉淀的混合物中加盐酸,最先溶解的是FeS. (1)机动车尾气和燃烧产生的烟气含氮的氧化物,可以用CH4催化还原NOx消除氮氧化物的污染.
(1)机动车尾气和燃烧产生的烟气含氮的氧化物,可以用CH4催化还原NOx消除氮氧化物的污染.
 .
.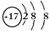 .
.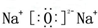 .F的原子结构示意图为
.F的原子结构示意图为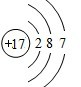 .
.