题目内容
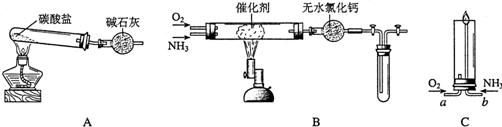
20.某同学设计如图所示的实验方案: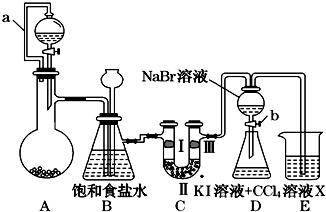
(1)A装置的分液漏斗里盛装浓盐酸,烧瓶里固体为重铬酸钾(K2Cr2O7),还原产物是CrCl3,写出A中离子方程式:Cr2O72-+14H++6Cl-═2Cr3++3Cl2↑+7H2O.
(2)本实验目的是制备氯气并探究氯气等物质的相关性质,B装置有几个作用,分别是除去氯气中的氯化氢、作安全瓶,检测实验过程中装置是否堵塞.拆去a导管的后果可能是浓盐酸不能顺利滴入烧瓶.
(3)装置C的功能是探究有氧化性的物质是否一定有漂白性,下列最佳试剂组合是②.
| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
(5)D装置进行实验时存在明显不足,它是没有排除氯气对溴单质与KI反应的干扰,合适的溶液X是①④⑥ (从①氢氧化钠溶液②亚硫酸钠溶液③亚硫酸氢钠溶液④氯化亚铁溶液⑤硫氢化钠溶液⑥碳酸氢钠溶液中选择).
分析 A中浓盐酸与重铬酸钾发生氧化还原反应生成氯气,涉及反应为Cr2O72-+14H++6Cl-=2Cr3++3Cl2↑+7H2O,B为安全瓶和洗气瓶,可用于除去氯化氢,C为干燥氯气的装置,只能用固体干燥剂,在D装置的b中氯气氧化溴化钠生成溴,氯气、溴在E中可置换碘,E为尾气处理装置;
(1)重铬酸钾具有强的氧化性,能够氧化浓盐酸生成氯气、氯化铬和水,依据氧化还原反应得失电子守恒、原子个数守恒书写方程式;
(2)根据装置图,推知实验目的是制备氯气探究氯气的性质以及卤素之间的置换;B装置的作用:饱和食盐水减少氯气的溶解,以及除去氯气中的氯化氢,同时还起安全瓶的作用,防止实验过程中发生堵塞,出现危险;导管a的作用是使烧瓶中的压强与分液漏斗中的压强相等,有利于液体顺利滴下,如果拆去a管,很有可能烧瓶中气体压强大,分液漏斗中液体不能顺利滴下;
(3)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(4)如果D装置分液漏斗内反应生成的溴能够置换出碘化钾溶液中的碘离子,即可证明溴的非金属性比碘的强,碘的四氯化碳溶液显紫红色;
(5)氯气氧化性强于碘离子,能够置换碘单质;氯气有毒,过量的氯气用E装置吸收,所以x应为能够与氯气反应,但不生成新的污染气体的液体.
解答 解:(1)重铬酸钾具有强的氧化性,能够氧化浓盐酸生成氯气、氯化铬和水,依据氧化还原反应得失电子守恒、原子个数守恒,反应的离子程式为:Cr2O72-+14H++6Cl-=2Cr3++7H2O+3Cl2↑;
故答案为:Cr2O72-+14H++6Cl-=2Cr3++7H2O+3Cl2↑;
(2)根据装置图,推知实验目的是制备氯气探究氯气的性质以及卤素之间的置换;B装置的作用:饱和食盐水减少氯气的溶解,以及除去氯气中的氯化氢,同时还起安全瓶的作用,防止实验过程中发生堵塞,出现危险;导管a的作用是使烧瓶中的压强与分液漏斗中的压强相等,有利于液体顺利滴下,如果拆去a管,很有可能烧瓶中气体压强大,分液漏斗中液体不能顺利滴下;
故答案为:制备氯气并探究氯气等物质的相关性质;作安全瓶,检测实验过程中装置是否堵塞;浓盐酸不能顺利滴入烧瓶;
(3)探究Cl2的漂白性,干燥的氯气不具有漂白性,湿润的氯气具有漂白性,①碱石灰能和氯气反应,吸收氯气,不能用碱石灰干燥氯气,故错误;②从B装置中出来的氯气还有少量水蒸气,能使干燥的红纸条褪色,经浓硫酸后,转变成干燥的氯气,不能使干燥的红纸条褪色,能够达到实验目的,故正确;③干燥的白纸条,颜色现象不明显,故错误;④氯化钠不具有干燥性,故错误;
故选:②;
(4)溴与碘化钾反应的离子方程式为:2I-+Br2=I2+2Br-,操作和现象为:实验完毕,打开活塞,使少量液体流入锥形瓶,关闭活塞,振荡锥形瓶,下层液体呈紫红色,
故答案为:实验完毕,打开活塞,使少量液体流入锥形瓶,关闭活塞,振荡锥形瓶,下层液体呈紫红色;
(5)氯气氧化性强于碘离子,能够置换碘单质,所以D装置进行实验时没有排除氯气对溴单质与KI反应的干扰;
氯气有毒,过量的氯气用E装置吸收,①氢氧化钠溶液 ②亚硫酸钠溶液 ③亚硫酸氢钠溶液 ④氯化亚铁溶液⑤硫氢化钠溶液 ⑥碳酸氢钠溶液.都能与氯气反应,但是②亚硫酸钠溶液 ③亚硫酸氢钠溶液与氯气反应时会生成二氧化硫⑤硫氢化钠溶液与氯气反应时均会生成硫化氢气体,二氧化硫和硫化氢都是有毒的气体,污染空气,所以不能用他们做吸收液,
故答案为:没有排除氯气对溴单质与KI反应的干扰;①④⑥.
点评 本题考查了氯气的制备、除杂、性质检验、尾气吸收装置的分析,注意明确实验装置及实验原理是解答的关键,题目难度中等.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
 .MX与水反应可放出气体,该反应的化学方程式为NaH+H2O=NaOH+H2↑.
.MX与水反应可放出气体,该反应的化学方程式为NaH+H2O=NaOH+H2↑.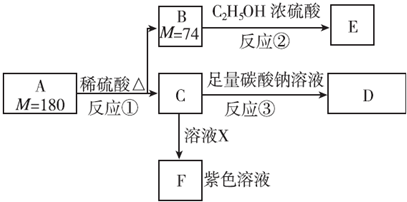
 ,1 mol A与足量NaOH溶液反应的化学方程式为
,1 mol A与足量NaOH溶液反应的化学方程式为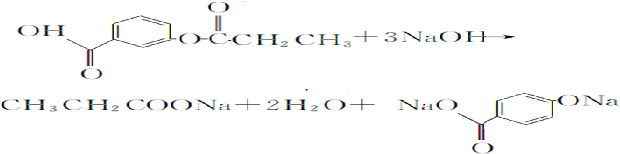 .
.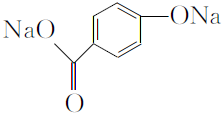 .
.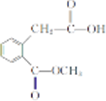 和
和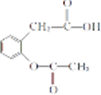 ,.
,.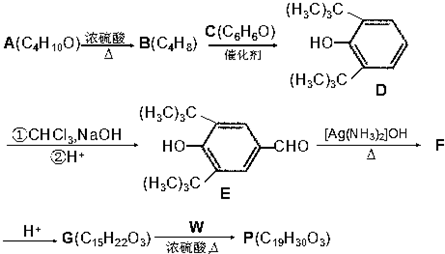
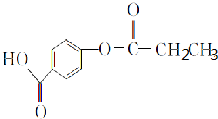
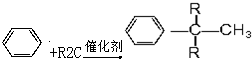 (R为烷基)
(R为烷基)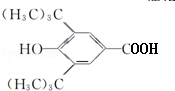 ;E中含有的官能团名称是羟基和醛基;
;E中含有的官能团名称是羟基和醛基;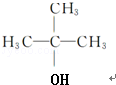 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O;该反应类型为消去反应;
+H2O;该反应类型为消去反应;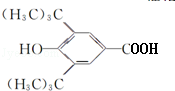 +CH3CH2CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$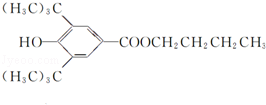 +H2O;该反应类型为酯化反应;
+H2O;该反应类型为酯化反应; 科学研究表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)
科学研究表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO) .
. ⑥
⑥ ⑦
⑦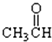 ⑧
⑧ ⑨
⑨ ⑩
⑩