题目内容
2.X、Y、Z、W、Q五种元素原子序数依次增大,X为地壳中含量最高的元素,在周期表中Y与X、Z、Q相邻,Q与X最高能层上的电子数相同,W原子核外有七种不同能级的电子,且最高能级上没有未成对电子,W与X可形成W2X和WX两种化合物.回答下列问题:
(1)X能与原子序数最小的元素形成原子个数比为1:1的分子,该分子的电子式为
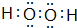 .
.(2)W2+的核外电子排布式为1s22s22p63s23p63d9.
(3)Z单质能溶于水,水液呈黄绿色,在其中通人Y的某种氧化物,溶液颜色褪去,用化学方程式表示原因Cl2+SO2+2H2O=2HCl+H2SO4.
(4)Y、Z元素的第一电离能Y<Z(填“>”、“<”或“=”). X与地壳中含量第二的元素形成的化合物所属的晶体类型为原子晶体.
(5)已知X分别与元素碳、氮形成化合物有如下反应:
2CX(g)+X2(g)═2CX2(g)△H=-566.0kJ•mol-1
N2(g)+X2(g)═2NX(g)△H=189.5kJ•mol-1
2NX(g)+X2(g)═2NX2(g)△H=-112.97kJ•mol-1
写出NX2与CX反应生成大气中存在的两种气态物质的热化学方程式:2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=-1208.53 kJ•mol-1.
(6)Y与磷原子形成P4Y3分子,该分子中没有π键,且各原子最外层均已达8电子结构,则一个P4Y3分子中含有的极性键和非极性键的个数分别为6个、3个.
分析 X、Y、Z、W、Q五种元素原子序数依次增大,X为地壳中含量最高的元素,则X为O元素,Q与X最高能层上的电子数相同,二者同主族,Y和X、Z、Q均相邻,故X、Y、Q同族,且Y在中间,则Y为硫,Q为硒,又Y、Z相邻,且Z的原子序数大于Y,故Z为氯,W有7个能级,分别为1s、2s、2p、3s、3p、3d、4s,且最高能级没有未成对电子,则3d能级上有10个电子,根据其形成的两种氧化物确定W为铜.
(1)O能与原子序数最小的元素H形成原子个数比为1:1的分子H2O2;
(2)Cu原子的4s能级、3d能级各失去1个电子形成Cu2+;
(3)Z的单质为氯气,水溶液呈黄绿色;在氯水中通人SO2,发生氧化还原反应,溶液颜色褪去;
(4)同一周期从左至右第一电离能呈增大起始;SiO2为典型的原子晶体.
(5)根据盖斯定律可以计算得到反应热,写出热化学方程式;
(6)可以想象为在P4(正四面体结构)分子中的每个P-P键中放入一个S原子,故有6个极性键、3个非极性键.
解答 解:X、Y、Z、W、Q五种元素原子序数依次增大,X为地壳中含量最高的元素,则X为O元素,Q与X最高能层上的电子数相同,二者同主族,Y和X、Z、Q均相邻,故X、Y、Q同族,且Y在中间,则Y为硫,Q为硒,又Y、Z相邻,且Z的原子序数大于Y,故Z为氯,W有7个能级,分别为1s、2s、2p、3s、3p、3d、4s,且最高能级没有未成对电子,则3d能级上有10个电子,根据其形成的两种氧化物确定W为铜.
(1)O能与原子序数最小的元素H形成原子个数比为1:1的分子H2O2,电子式为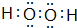 ,
,
故答案为: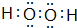 ;
;
(2)Cu2+的核外电子排布式为1s22s22p63s23p63d9,
故答案为:1s22s22p63s23p63d9;
(3)Z的单质为氯气,水溶液呈黄绿色;在氯水中通入SO2,发生氧化还原反应,溶液颜色褪去,反应方程式为:Cl2+SO2+2H2O=2HCl+H2SO4,
故答案为:黄绿色;Cl2+SO2+2H2O=2HCl+H2SO4;
(4)同一周期从左至右第一电离能车呈增大趋势,故第一电离能S<Cl;SiO2为典型的原子晶体,
故答案为:<;原子晶体;
(5)已知:①.2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
②.N2(g)+O2(g)═2NO(g)△H=189.5kJ•mol-1
③.2NO(g)+O2(g)═2NO2(g)△H=-112.97kJ•mol-1
根据盖斯定律,①×2-②-③
2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=-1208.53 kJ•mol-1,
故答案为:2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=-1208.53 kJ•mol-1;
(6)可以想象为在P4(正四面体结构)分子中的每个P-P键中放入一个S原子,故有6个极性键、3个非极性键,
故答案为:6;3.
点评 本题以元素推断为基础,考查原子结构、分子结构、元素周期律、元素及化合物、热化学方程式的书写、盖斯定律等知识,注意对基础知识的理解掌握.

| 选项 | 操作和现象 | 结论 |
| A | 切开金属钠,钠表面的银白色会逐渐变暗 | Na在空气中会生成Na2O2 |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | SO2通入酸性KMnO4溶液,溶液褪色 | SO2具有漂白性 |
| D | 将充满NO2的试管倒立在水中,试管内液面约上升至试管容积的$\frac{2}{3}$处;缓慢通入O2,轻轻晃动试管,至液体基本上充满试管 | 从原料的充分利用和减少污染物的排放等方面考虑,该实验对工业生产硝酸有重要启示 |
| A. | A | B. | B | C. | C | D. | D |
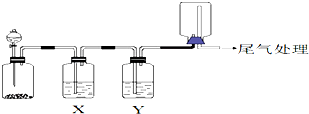
| 选项 | 实验目的 | X中试剂 | Y中试剂 |
| A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
| C | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| D | 氨水与生石灰反应制取并收集纯净干燥的NH3 | 饱和NaOH溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |


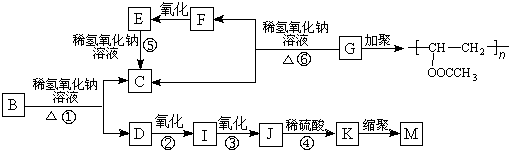
 .
.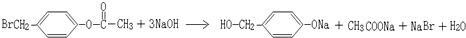 ,K与少量的氢氧化钠溶液反应:
,K与少量的氢氧化钠溶液反应: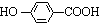 +NaOH→
+NaOH→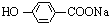 +H2O.
+H2O.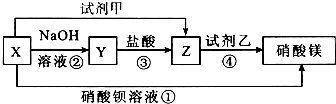
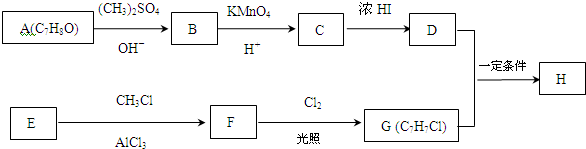
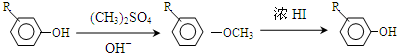

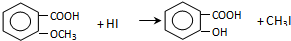 .
.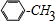 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$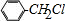 +HCl,反应类型为取代反应.
+HCl,反应类型为取代反应.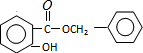 .
. (或
(或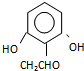 )(任写一种即可)
)(任写一种即可) 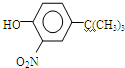
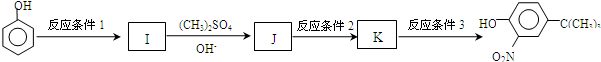
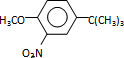 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.
 科学研究表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)
科学研究表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO) .
.