题目内容
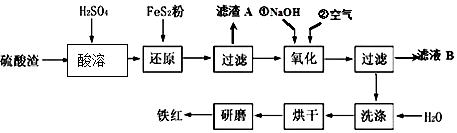
13.某化工厂用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2,其部分生产流程如下:
已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
| 开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
| 完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
(2)写出FeS和MnO2和稀硫酸反应的离子方程式:2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O.
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3.pH调节的范围是5.2~6.4,试剂X可以选用AC(填选项字母).
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3•H2O
(4)电解(Ⅴ)中阳极的电极反应式为Mn2++2H2O-2e-=MnO2+4H+.
(5)Zn和MnO2是制作电池的原料.某锌-锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s).该电池的正极的电极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-.
分析 用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2,加入稀硫酸加热、浸取,过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液,滤渣为S,加入试剂X加热,其作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3.pH调节的范围是5.2~6.4,过滤得到滤液含MnSO4、ZnSO4,加入硫酸后电解得到锌和二氧化锰,
(1)矿石粉碎可以增大固体与溶液的接触面积;
(2)FeS和MnO2和稀硫酸反应生成硫单质,硫酸锰、硫酸铁和水,
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3.结合图表数据分析,选择溶液PH能使铁离子、铝离子全部沉淀,锰离子不沉淀,加入试剂不能引入新的杂质;
(4)电解(Ⅴ)中是电解硫酸锰溶液,阳极上是锰离子失电子生成二氧化锰发生氧化反应;
(5)根据电极反应式Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),可知电池工作时,负极材料是Zn,发生氧化反应生成Zn(OH)2,正极材料为MnO2,发生还原反应,以此解答该题;
解答 解:(1)加热、浸取时所加矿石均需粉碎,其目的是:加快反应(浸取)速率,
故答案:加快反应(浸取)速率;
(2)FeS和MnO2和稀硫酸反应的离子方程式:2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O,
故答案为:2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O;
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3.结合图表数据分析,选择溶液PH能使铁离子、铝离子全部沉淀,锰离子不沉淀,图表中离子开始菜单和菜单完全的溶液PH得到,pH调节的范围是:5.2~6.4,加入试剂不能引入新的杂质,试剂X可以选择,
A.MnCO3 和酸反应且不引入新的杂质,故A正确;
B.Na2CO3 和酸反应但会引入新的杂质钠离子,故B错误;
C.Zn2(OH)2CO3 和酸反应,不引入新的杂质,故C正确;
D.NH3•H2O和酸反应,但会引入新的杂质铵根离子,故D错误;
故答案为:5.2~6.4;AC;
(4)电解ZnSO4、MnSO4溶液,根据溶液中离子的放电顺序,阳极反应:Mn2+-2e-+2H2O═MnO2+4H+,Fe作阴极,阴极反应:Zn2++2e-═Zn,
故答案为:Mn2++2H2O-2e-=MnO2+4H+;
(5)根据电极反应式Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),可知电池工作时,负极材料是Zn,发生氧化反应生成Zn(OH)2,电极反应式为Zn-2e-+2OH-=Zn(OH)2,正极材料为MnO2,发生还原反应,电极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-,电子从负极沿导线流向正极,
故答案为:2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-.
点评 本题是一道综合性题目,考查的知识点较广泛,要注意知识点之间的联系,分析问题要细致,考虑问题要全面,绝不能断章取义,否则就容易出错,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 单甘油酯、混甘油酯、苛性钾、氢硫酸、三氧化硫 | |
| B. | 胆矾、漂白粉、硫酸钠、次氯酸、氨气 | |
| C. | 明矾、水煤气、盐酸.醋酸、铜 | |
| D. | 冰醋酸、福尔马林、硫酸钡、氢硫酸、乙醇 |
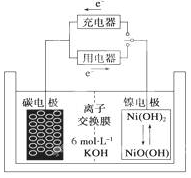 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )| A. | 放电时K+移向负极 | |
| B. | 放电时电池负极的电极反应为H2-2e-═2H+ | |
| C. | 放电时电池正极的电极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| D. | 该电池充电时将碳电极与电源的正极相连,发生氧化反应 |
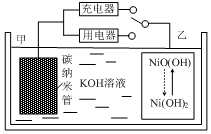 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 放电时,甲电极为正极,OH-移向乙电极 | |
| B. | 放电时,乙电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- | |
| C. | 充电时,电池的碳电极与直流电源的正极相连 | |
| D. | 电池总反应为H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2 |
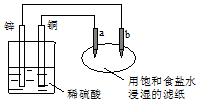
| A. | 往滤纸上滴加酚酞试液,a极附近颜色变红 | |
| B. | 锌电极上的反应:Zn-2e→Zn2+ | |
| C. | 稀硫酸中硫酸根离子的物质的量不变 | |
| D. | a是阳极,发生氧化反应 |
 近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2,下列说法不正确的是( )
近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2,下列说法不正确的是( )| A. | 太阳能最终转变为化学能 | B. | CeO2是水分解的催化剂 | ||
| C. | T<1050℃时,CeO2-δ比CeO2稳定 | D. | 两步反应均属于氧化还原反应 |

 .
.