题目内容
8.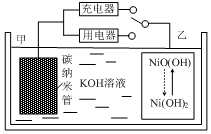 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 放电时,甲电极为正极,OH-移向乙电极 | |
| B. | 放电时,乙电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- | |
| C. | 充电时,电池的碳电极与直流电源的正极相连 | |
| D. | 电池总反应为H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2 |
分析 开关连接用电器时,应为原电池原理,甲电极为负极,负极上氢气失电子发生氧化反应,电极反应式为H2+2OH--2e-═2H2O,乙电极为正极得电子发生还原反应,电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH-;开关连接充电器时,为电解池,充电与放电过程相反,据此解答.
解答 解:A.放电时,该电池为原电池,电解质溶液中阴离子向负极移动,所以OH-向负极甲电极移动,故A错误;
B.放电时,乙电极为正极得电子发生还原反应,电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH-,故B正确;
C.放电时,氢气在碳电极发生氧化反应,碳电极作负极,充电时,碳电极发生还原反应作阴极,应与电源的负极相连,故C错误;
D.放电时,正极电极反应式为2NiO(OH)+2H2O+2e-═2Ni(OH)2+2OH-,负极电极反应式为:H2+2OH--2e-═2H2O,则两式相加得总反应:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2,故D正确;
故选BD.
点评 本题考查了原电池和电解池原理,明确正负极上发生的电极反应及阴阳离子的移动方向即可解答,易错选项是C,注意结合电解原理确定与原电池哪个电极相连,为易错点.

练习册系列答案
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
18.0.1molCu、0.lmolH2SO4、0.1lmolHNO3混合共1L,充分反应,下列预测正确的是( )
| A. | 铜全部溶解,且溶液为蓝色,有红棕色气体产生 | |
| B. | 铜部分溶解,且溶液为蓝色,有红棕色气体产生 | |
| C. | 铜全部溶解,且溶液为蓝色,有无色气体产生 | |
| D. | 铜部分溶解,且溶液为蓝色,有无色气体产生 |
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 水电离的c( H+)=1×l0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42- | |
| B. | 能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- | |
| C. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- | |
| D. | 1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl |
16.下列叙述正确的是( )
| A. | NH4Cl是电解质,所以NH4Cl溶液是电解质 | |
| B. | Al2O3是两性氧化物,所以它能溶解于盐酸也能溶于氨水中 | |
| C. | 用FeCl3溶液制作印刷电路板的原因是Fe3+具有氧化性 | |
| D. | Fe(OH)3胶体的本质特征是能产生丁达尔效应 |
3.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,11.2 L CCl4中含有的分子数为0.5NA | |
| B. | 在Na2O2与水的反应中,每生成1 mol O2,转移电子的数为2NA | |
| C. | 常温常压下,7.8 g苯中含有双键的数目为0.3NA | |
| D. | 25℃时,0.1 mol•L-1 NH4NO3溶液中含有的铵根离子数为0.1NA |
13.某化工厂用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2,其部分生产流程如下:

已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)如下表:
(1)加热、浸取时所加矿石均需粉碎,其目的是加快反应(浸取)速率.
(2)写出FeS和MnO2和稀硫酸反应的离子方程式:2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O.
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3.pH调节的范围是5.2~6.4,试剂X可以选用AC(填选项字母).
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3•H2O
(4)电解(Ⅴ)中阳极的电极反应式为Mn2++2H2O-2e-=MnO2+4H+.
(5)Zn和MnO2是制作电池的原料.某锌-锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s).该电池的正极的电极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-.

已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
| 开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
| 完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
(2)写出FeS和MnO2和稀硫酸反应的离子方程式:2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O.
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3.pH调节的范围是5.2~6.4,试剂X可以选用AC(填选项字母).
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3•H2O
(4)电解(Ⅴ)中阳极的电极反应式为Mn2++2H2O-2e-=MnO2+4H+.
(5)Zn和MnO2是制作电池的原料.某锌-锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s).该电池的正极的电极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-.
20.下列各组表达式意义相同的是( )
| A. | -NO2、NO2 | B. | -OH、 | C. | -COOH、HCOO- | D. | HCOOCH3、HOOCCH3 |
17.下列说法正确的是( )
| A. | 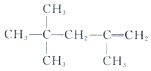 的名称为:2,2,4-三甲基-4-戊烯 的名称为:2,2,4-三甲基-4-戊烯 | |
| B. | 碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种 | |
| C. | 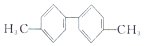 分子中至少有10个碳原子处于同一平面 分子中至少有10个碳原子处于同一平面 | |
| D. | 1 mol β-紫罗兰酮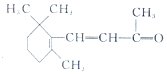 与1 mol H2发生加成反应可得到3种不同产物 与1 mol H2发生加成反应可得到3种不同产物 |
10.二甲醚(CH3OCH3)被称为21世纪的新型燃料,未来可能替代柴油和液化气作为洁净液体燃料使用.
(1)工业上利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)△H=a kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=b kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=c kJ•mol-1
现在采用新工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),该反应的△H=(2a+b+c)kJ•mol-1,平衡常数表达式K=$\frac{c(C{H}_{3}OC{H}_{3})c(C{O}_{2})}{{c}^{3}(CO){c}^{3}({H}_{2})}$.
(2)增大压强,CH3OCH3的产率增大(填“增大”“减小”或“不变”).
(3)原工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.新工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率.
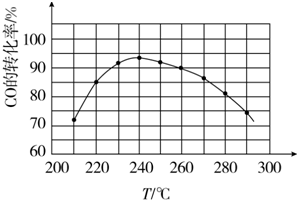
(4)为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气的组成、压强、反应时间等因素不变,实验结果如图.CO转化率随温度变化的规律是温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小,其原因是在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小.
(5)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v(正)>(填“>”“<”或“=”)v(逆).
②若开始只加入CH3OH,经10min后反应达到平衡,平衡时CH3OH的转化率α(CH3OH)=97.5%.
(1)工业上利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)△H=a kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=b kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=c kJ•mol-1
现在采用新工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),该反应的△H=(2a+b+c)kJ•mol-1,平衡常数表达式K=$\frac{c(C{H}_{3}OC{H}_{3})c(C{O}_{2})}{{c}^{3}(CO){c}^{3}({H}_{2})}$.
(2)增大压强,CH3OCH3的产率增大(填“增大”“减小”或“不变”).
(3)原工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.新工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率.
(4)为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气的组成、压强、反应时间等因素不变,实验结果如图.CO转化率随温度变化的规律是温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小,其原因是在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小.

(5)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol•L-1 | 0.64 | 0.50 | 0.50 |
②若开始只加入CH3OH,经10min后反应达到平衡,平衡时CH3OH的转化率α(CH3OH)=97.5%.