题目内容
1.铁及其化合物在日常生活、生产中应用广泛.(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,工业上利用NaClO 和NaOH的混合溶液将Fe(OH)3氧化性制备高铁酸钠,反应的化学方程式为2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O;高铁酸钠能用作新型净水剂的原理是本身具有强氧化性可杀菌消毒,在反应中被还原成三价铁离子水解生成氢氧化铁胶体净水,Fe3++3H2O?Fe(OH)3(胶体)+3H+;(用离子方程式表示).
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
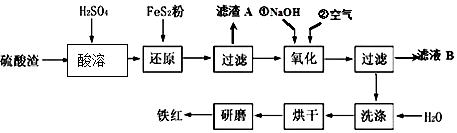
①酸溶过程中发生反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,Al2O3+3H2SO4═Al2(SO4)3+3H2O,MgO+H2SO4═MgSO4+H2O;“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请写出该反应的离子方程式FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+;
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
分析 (1)NaClO和NaOH的混合溶液将Fe(OH)3氧化得到高铁酸钠,NaClO和NaOH的混合溶液将Fe(OH)3氧化得到高铁酸钠,NaClO本身应该被还原为NaCl,结合质量守恒和原子守恒书写化学方程式,高铁酸钠本身具有强氧化性,还原产物Fe3+可水解得到胶体;
(2)硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,加入FeS2将溶液中的Fe3+还原为Fe2+,再加氢氧化钠和空气,调节溶液的pH主要是使三价铁沉淀,而二价镁,三价铝都不沉淀,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红;
①氧化铁、MgO属于碱性氧化物,Al2O3是两性氧化物,都能与酸反应生成盐和水;Fe2O3、Al2O3、MgO都和硫酸反应,二氧化硅不和酸反应;
②FeS2将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,根据得失电子守恒和原子守恒书写离子反应式并配平;
③NaOH与Fe2+反应生成的氢氧化亚铁易被氧化.
解答 解:(1)NaClO和NaOH的混合溶液将Fe(OH)3氧化得到高铁酸钠,发生反应的化学方程式为2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O,高铁酸钠本身具有强氧化性可杀菌消毒,在反应中被还原成三价铁离子水解生成氢氧化铁胶体净水,反应离子方程式为:Fe3++3H2O?Fe(OH)3(胶体)+3H+;故答案为:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O;本身具有强氧化性可杀菌消毒,在反应中被还原成三价铁离子水解生成氢氧化铁胶体净水,Fe3++3H2O?Fe(OH)3(胶体)+3H+;
(2)①硫酸与氧化铁反应生成硫酸铁和水,方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,硫酸与Al2O3反应生成硫酸铝和水,方程式为:Al2O3+3H2SO4═Al2(SO4)3+3H2O,硫酸与MgO反应生成硫酸镁和水,方程式为:MgO+H2SO4═MgSO4+H2O,因二氧化硅不与硫酸反应,故“滤渣A”主要成份的化学式为SiO2.
故答案为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O、Al2O3+3H2SO4═Al2(SO4)3+3H2O、MgO+H2SO4═MgSO4+H2O;SiO2;
②FeS2中S元素的化合价从-1价升高到+6价,2个S原子转移14个电子,Fe3+转移1个电子,则二者的计量数之比为1:14,根据S守恒可知SO42-前面的化学计量数为2,根据氧守恒可知H20前面化学计量数为8,根据H守恒可知H+前化学计量数为16,则反应的离子方程式为:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+,
故答案为:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+;
③Fe2+与OH-反应生成4Fe(OH)2,Fe(OH)2不稳定易被氧气氧化为Fe(OH)3,用化合价升价法配平方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓,
故答案为:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
点评 本题通过制备铁红,考查了物质制备方案的设计及化学实验基本操作方法的综合应用,题目难度中等,明确制备流程及化学实验基本操作方法为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案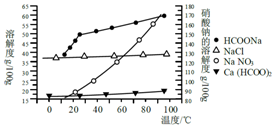 甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.Ⅰ.实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30~70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛的利用率和产品纯度.
(2)反应温度最好控制在30~70℃之间,温度不易过高,其主要原因是防止H2O2分解和甲醛挥发 .
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是除去重金属离子.
(4)实验时需强力搅拌45min,其目的是使反应物充分接触,提高产率;结束后需调节溶液的pH 7~8,其目的是防止甲酸钙水解.最后经结晶分离、干燥得产品.
Ⅱ.某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合下图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算),现提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
| 金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤1:称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2:用稍过量硝酸溶解碳酸钙样品.
步骤3:用石灰水调整溶液pH=5.
步骤4:过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、趁热过滤、洗涤、60℃时干燥得甲酸钙晶体.
| A. | 烟花燃放,五彩缤纷的焰火体现了某些金属元素的物理性质 | |
| B. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 | |
| C. | 淀粉和纤维素都能水解,水解最终产物都为葡萄糖 | |
| D. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
| A. | 36g镁在足量的氮气中完全燃烧共转移的电子数为3NA | |
| B. | 室温下,21.0g乙烯和丁烯的混合气体中含有的C-H共价键数目为3NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA | |
| D. | 1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
| A. | NH4Cl是电解质,所以NH4Cl溶液是电解质 | |
| B. | Al2O3是两性氧化物,所以它能溶解于盐酸也能溶于氨水中 | |
| C. | 用FeCl3溶液制作印刷电路板的原因是Fe3+具有氧化性 | |
| D. | Fe(OH)3胶体的本质特征是能产生丁达尔效应 |
a.CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g)△H1=+256.6kJ•mol-1
b.2CH3CH2OH(g)+O2(g)=6H2(g)+4CO(g)△H2=+27.6kJ•mol-1
则下列说法正确的是( )
| A. | 升高a的反应温度,乙醇的转化率增大 | |
| B. | 由b可知:乙醇的燃烧热为13.8 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)=2H2O(g)△H=+485.6 kJ•mol-1 | |
| D. | 制取等量的氢气,途径b消耗的能量更多 |

已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
| 开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
| 完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
(2)写出FeS和MnO2和稀硫酸反应的离子方程式:2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O.
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3.pH调节的范围是5.2~6.4,试剂X可以选用AC(填选项字母).
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3•H2O
(4)电解(Ⅴ)中阳极的电极反应式为Mn2++2H2O-2e-=MnO2+4H+.
(5)Zn和MnO2是制作电池的原料.某锌-锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s).该电池的正极的电极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-.
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32-一定存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
 氢气是新型能源和重要化工原料.
氢气是新型能源和重要化工原料.已知:①2CO(g)+O2(g)=2CO2(g)△H1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2
(1)科学家提出一种利用天然气制备氢气的方法:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H,△H=△H2-△H1-2△H3,这种方法的推广与使用,不仅实现资源综合利用,而且还能解决环境问题是减少二氧化碳排放,缓解温室效应.
(2)氨气是重要化工原料,在国民经济中占重要地位.
①在恒温、容积相等的恒容密闭容器中投入一定量氮气、氢气,发生如下可逆反应:
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
实验测得起始、平衡时的有关数据如表所示:
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3n | n | 0 | 放出热量a kJ |
| Ⅱ | 3n | 2n | 0 | 放出热量b kJ |
| Ⅲ | 6n | 2n | 0 | 放出热量c kJ |
A.N2的转化率:Ⅱ>I>Ⅲ
B.放出热量:a<b<92.4n
C.达到平衡时氨气的体积分数:Ⅲ>Ⅰ
D.平衡常数:Ⅲ>Ⅱ>Ⅰ
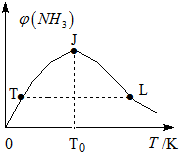
②在密闭恒容容器中投入一定量氮气和氢气,混合气体中氨气体积分数和温度关系如图所示:
曲线TJ段变化主要原因是平衡之前,反应向生成氨方向进行,JL段变化的主要原因是该正反应是放热反应,平衡之后,升高温度,平衡向逆方向移动,促进氨分解,氨的体积分数减小,氨气正反应速率:T点小于小于L点(填:大于、小于或等于).
③在2L密闭容器中充入一定量的氨气,氨气的物质的量与反应时间关系如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | … |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 |
④常温下,在V mL的a mol•L-1稀硫酸溶液中滴加b mol•L-1稀氨水V mL恰好使混合溶液呈中性.此时,一水合氨的电离常数Kb=$\frac{2a}{(b-2a)×1{0}^{7}}$(用含a、b代数式表示).
(3)氢气直接作燃料电池的理论输出电压为1.2V,能量密度E=$\frac{\frac{1.2V×\frac{1000g}{2g/mol×2×96500C/mol}}{1kg}}{3.6×1{0}^{6}J•k{W}^{-1}•{h}^{-1}}$=32.2kW•h•kg-1(列式计算,精确到小数点后一位.提示:能量密度=电池输出电能/燃料质量,1kW•h=3.6×106J,常用单位为kW•h•kg-1).