题目内容
3.下列物质按纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是( )| A. | 单甘油酯、混甘油酯、苛性钾、氢硫酸、三氧化硫 | |
| B. | 胆矾、漂白粉、硫酸钠、次氯酸、氨气 | |
| C. | 明矾、水煤气、盐酸.醋酸、铜 | |
| D. | 冰醋酸、福尔马林、硫酸钡、氢硫酸、乙醇 |
分析 纯净物是指由同种物质组成的,混合物是指由不同种物质组成的,
电解质是指在水溶液里或熔化状态下能够导电的化合物,非电解质是指在水溶液里和熔化状态下都不能够导电的化合物,
据此可以分析各个选项中各种物质的所属类别.
解答 解:A.混甘油酯是一种纯净的化合物,故A错误;
B.胆矾是一种物质组成的纯净物、漂白粉是氯化钙和次氯酸钙组成的混合物、硫酸钠水溶液中完全电离属于强电解质、次氯酸水溶液中部分电离属于弱电解质、氨气不能电离属于非电解质,故B正确;
C.元素为氯化氢的水溶液属于混合物,铜是单质既不是电解质也不是非电解质,故C错误;
D.冰醋酸是一种物质组成的纯净物、福尔马林是甲醛的水溶液属于混合物、硫酸钡熔融状态完全电离属于强电解质、氢硫酸水溶液中部分电离属于弱电解质、乙醇不能电离属于非电解质,故D正确,故选BD.
点评 本题考查了纯净物、混合物、电解质、非电解质的概念判断及各种物质的成分掌握,题目难度中等.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
11.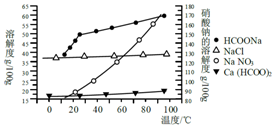 甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
Ⅰ.实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30~70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛的利用率和产品纯度.
(2)反应温度最好控制在30~70℃之间,温度不易过高,其主要原因是防止H2O2分解和甲醛挥发 .
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是除去重金属离子.
(4)实验时需强力搅拌45min,其目的是使反应物充分接触,提高产率;结束后需调节溶液的pH 7~8,其目的是防止甲酸钙水解.最后经结晶分离、干燥得产品.
Ⅱ.某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合下图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算),现提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
实验步骤
步骤1:称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2:用稍过量硝酸溶解碳酸钙样品.
步骤3:用石灰水调整溶液pH=5.
步骤4:过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、趁热过滤、洗涤、60℃时干燥得甲酸钙晶体.
 甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.Ⅰ.实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30~70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛的利用率和产品纯度.
(2)反应温度最好控制在30~70℃之间,温度不易过高,其主要原因是防止H2O2分解和甲醛挥发 .
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是除去重金属离子.
(4)实验时需强力搅拌45min,其目的是使反应物充分接触,提高产率;结束后需调节溶液的pH 7~8,其目的是防止甲酸钙水解.最后经结晶分离、干燥得产品.
Ⅱ.某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合下图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算),现提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
| 金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤1:称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2:用稍过量硝酸溶解碳酸钙样品.
步骤3:用石灰水调整溶液pH=5.
步骤4:过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、趁热过滤、洗涤、60℃时干燥得甲酸钙晶体.
18.0.1molCu、0.lmolH2SO4、0.1lmolHNO3混合共1L,充分反应,下列预测正确的是( )
| A. | 铜全部溶解,且溶液为蓝色,有红棕色气体产生 | |
| B. | 铜部分溶解,且溶液为蓝色,有红棕色气体产生 | |
| C. | 铜全部溶解,且溶液为蓝色,有无色气体产生 | |
| D. | 铜部分溶解,且溶液为蓝色,有无色气体产生 |
8.常温下,往5%的H2O2溶液中滴加2~3滴FeCl3溶液,可发生如下两个反应:
①2Fe3++H2O2═2Fe2++O2↑+2H+②2Fe2++H2O2+2H+═2Fe3++2H2O
下列说法不正确的是( )
①2Fe3++H2O2═2Fe2++O2↑+2H+②2Fe2++H2O2+2H+═2Fe3++2H2O
下列说法不正确的是( )
| A. | Fe3+在反应①中作氧化剂,在反应②中为氧化产物 | |
| B. | 若生成标准状况下22.4 L O2,则整个过程中转移电子总数为2 mol | |
| C. | 在H2O2分解过程中,溶液的pH逐渐减小 | |
| D. | 在工业生产H2O2过程中要严格避免混入Fe3+ |
15.化学与生产、生活、环境等社会实际密切相关.下列叙述正确的是( )
| A. | “滴水石穿、绳锯木断”不涉及化学变化 | |
| B. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| C. | 明矾净水的原理和“84”消毒液消毒的原理不相同 | |
| D. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 |
12.下列关于物质性质的认识错误的是( )
| A. | 烟花燃放,五彩缤纷的焰火体现了某些金属元素的物理性质 | |
| B. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 | |
| C. | 淀粉和纤维素都能水解,水解最终产物都为葡萄糖 | |
| D. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
13.某化工厂用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2,其部分生产流程如下:

已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)如下表:
(1)加热、浸取时所加矿石均需粉碎,其目的是加快反应(浸取)速率.
(2)写出FeS和MnO2和稀硫酸反应的离子方程式:2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O.
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3.pH调节的范围是5.2~6.4,试剂X可以选用AC(填选项字母).
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3•H2O
(4)电解(Ⅴ)中阳极的电极反应式为Mn2++2H2O-2e-=MnO2+4H+.
(5)Zn和MnO2是制作电池的原料.某锌-锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s).该电池的正极的电极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-.

已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
| 开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
| 完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
(2)写出FeS和MnO2和稀硫酸反应的离子方程式:2FeS+3MnO2+12H+=2Fe3++2S↓+3Mn2++6H2O.
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3.pH调节的范围是5.2~6.4,试剂X可以选用AC(填选项字母).
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3•H2O
(4)电解(Ⅴ)中阳极的电极反应式为Mn2++2H2O-2e-=MnO2+4H+.
(5)Zn和MnO2是制作电池的原料.某锌-锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s).该电池的正极的电极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-.
 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题: 1,3-丁二烯(CH2=CHCH=CH2)和2-丁炔(CH3C CH3)是重要的有机原料.
1,3-丁二烯(CH2=CHCH=CH2)和2-丁炔(CH3C CH3)是重要的有机原料.