题目内容
11.用NA表示阿伏伽德罗常数,下列叙述正确的是( )| A. | 1molOH-所含质子数为10NA | |
| B. | 常温常压下,28克CO和N2的混合气体所含原子数为2NA | |
| C. | 4g氢气中含有的原子数为2NA | |
| D. | 标准状况下,11.2L酒精含有的分子数为0.5NA |
分析 A、氢氧根中含10个质子;
B、CO和氨气的摩尔质量均为28g/mol,且均含2个原子;
C、氢气由氢原子构成;
D、标况下酒精为液态.
解答 解:A、氢氧根中含10个质子,故1mol氢氧根中含9NA个质子,故A错误;
B、CO和氨气的摩尔质量均为28g/mol,故28g混合物的物质的量为1mol,且两者均含2个原子,故1mol混合物中含2NA个原子,故B正确;
C、氢气由氢原子构成,故4g氢气中含4mol氢原子即4NA个,故C错误;
D、标况下酒精为液态,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.室温下,0.1mol/L氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )
①电离程度增大 ②$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 ③c(H+) 增大④导电性增强 ⑤$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大.
①电离程度增大 ②$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 ③c(H+) 增大④导电性增强 ⑤$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大.
| A. | 仅①②③ | B. | 仅①③④ | C. | 仅①③⑤ | D. | 仅②③④ |
2.下列有关有机物说法正确的是( )
| A. | 取少量卤代烃加入NaOH水溶液共热,冷却,再加入AgNO3溶液检验卤代烃中卤原子的存在 | |
| B. | 用酸性KMnO4溶液直接检验乙醇与浓硫酸反应的产物是否得到乙烯 | |
| C. | 用燃烧的方法可鉴别甲烷与乙炔 | |
| D. | 将苯逐滴滴入浓硝酸和稀硫酸的混合液中,并用沸水浴加热制取硝基苯 |
19.生产中通常用铁制容器盛装下列哪一溶液?( )
| A. | 氯化铜溶液 | B. | 稀硫酸 | C. | 浓盐酸 | D. | 浓硝酸 |
6.下列有关性质的比较中,不正确的是( )
| A. | 金属原子化热:Na<Mg<Al | B. | 晶格能:NaBr<NaCl<MgO | ||
| C. | 键的极性:N-H<O-H<F-H | D. | 熔点: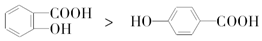 |
5.欲增加Mg(OH)2在水中的溶解,可采用的方法是( )
| A. | 增加溶液pH | B. | 加入2.0 mol/L NH4Cl | ||
| C. | 加入0.1 mol/L MgSO4 | D. | 加入适量95%乙醇 |
6.下列离方方程式书写正确的是( )
| A. | 铁与醋酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 硫酸铜溶液与氢氢化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| C. | 铜与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| D. | 碳酸氢钙与盐酸反应:HCO3-+H+═H2O+CO2↑ |
 将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题: 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: