题目内容
1. 将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$
(2)反应进行到t1时,SO2的体积分数为9.5%;
(3)若在t1时充入一定量的氩气(Ar),SO2的物质的量将增大(填“增大”、“减小”或“不变”);
(4)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量>2.1mol(填“<”、“>”或“=”),简单说明原因升高温度反应向吸热反应方向进行,即化学平衡向逆反应方向移动,气体的总物质的量增大;
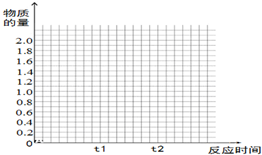
(5)若其它条件不变,在t1时再加入0.2molSO2、0.1molO2和1.8molSO3,在图中作出从t0→t1→t2点这段时间内SO2的物质的量变化曲线.
分析 (1)平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,固体和纯液体不写入表达式;
(2)根据t1点时达到平衡状态,测得混合气体总物质的量为2.1mol,计算出平衡时二氧化硫的物质的量,再计算出SO2的体积分数;
(3)体积可变,压强恒定的密闭容器中充入一定量的氩气(Ar),体积增大,反应物的分压减小,根据压强对平衡的影响分析;
(4)根据温度对平衡的影响分析;
(5)t0到t1时起点在坐标(0,2)、平衡点在坐标(t1,0.2)处;恒压条件下,在t1时再加入0.2molSO2、0.1molO2和1.8molSO3,与原平衡是等效平衡,所以t1到t2 是平行于时间轴的直线,起点必须在(t1,0.4)据此作图.
解答 解:(1)2SO2(g)+O2(g)?2SO3(g);△H<0,平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$,
故答案为:$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$;
(2)设参加反应的二氧化硫为nmol,则
2SO2(g)+O2(g)?2SO3(g),
初始量(mol) 2 1 0
转化量(mol) n $\frac{n}{2}$ n
平衡量(mol) 2-n 1-$\frac{n}{2}$ n
已知平衡状态时,测得混合气体总物质的量为2.1mol,即:2-n+1-$\frac{n}{2}$+n=2.1mol,解得n=1.8mol,所以t1时,SO2的体积分数为$\frac{2-1.8}{2.1}$×100%=9.5%;
故答案为:9.5%;
(3)体积可变,压强恒定的密闭容器中充入一定量的氩气(Ar),体积增大,反应物的分压减小,所以平衡向体积增大的方向移动,即向逆反方向移动,所以SO2的物质的量增大,故答案为:增大;
(4)已知该反应的正方向为放热反应,所以升高温度平衡逆移,逆方向为物质的量增大的方向,所以新平衡混合物中气体的总物质的量>2.1mol,
故答案为:>;升高温度反应向吸热反应方向进行,即化学平衡向逆反应方向移动,气体的总物质的量增大;
(5)t0到t1时起点在坐标(0,2)、平衡点在坐标(t1,0.2)处;恒压条件下,在t1时再加入0.2molSO2、0.1molO2和1.8molSO3,与原平衡是等效平衡,所以t1到t2 是平行于时间轴的直线,起点必须在(t1,0.4),图象为:
故答案为: .
.
点评 本题考查了平衡移动、化学平衡图象等,题目难度中等,本题作图时要注意对等效平衡的分析.

 阅读快车系列答案
阅读快车系列答案| A. | NH4Cl | B. | NH4HSO4 | C. | CH3COONH4 | D. | NH4HCO3 |
| A. | 溶液的导电性与溶液中离子的浓度有关 | |
| B. | 溶液的导电性与溶液中离子数目的多少有关 | |
| C. | 恰好完全反应时,溶液不易导电,所以BaSO4和水都是非电解质 | |
| D. | 往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
| A. | 1molOH-所含质子数为10NA | |
| B. | 常温常压下,28克CO和N2的混合气体所含原子数为2NA | |
| C. | 4g氢气中含有的原子数为2NA | |
| D. | 标准状况下,11.2L酒精含有的分子数为0.5NA |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{c^3({H}_{2}O)}{c^3({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
(4)已知:温度过高时,WO2 (s)转变为WO2(g);
WO2 (s)+2H2 (g)?W (s)+2H2O (g);△H=+66.0kJ•mol-1
WO2 (g)+2H2?W (s)+2H2O (g);△H=-137.9kJ•mol-1
则WO2(s)?WO2 (g) 的△H=+203.9kJ•mol-1.
| A. | Na2S溶液 | B. | AlCl3溶液 | C. | NaOH溶液 | D. | CaCl2溶液 |
| A. | 酸:阳离子全部为H+ | |
| B. | 纯净物与混合物:是否仅含有一种元素 | |
| C. | 强弱电解质:溶液的导电能力大小 | |
| D. | 溶液与胶体:本质区别是能否发生丁达尔效应 |

 ,并写出元素b的单质在二氧化碳中燃烧的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
,并写出元素b的单质在二氧化碳中燃烧的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C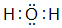 ,写出f元素单质与该氢化物反应的离子方程式:Cl2+H2O=H++Cl-+HClO.
,写出f元素单质与该氢化物反应的离子方程式:Cl2+H2O=H++Cl-+HClO.