题目内容
19.2015年CES消费电子展开幕前夕,丰田汽车公司宣布将会开放氢燃料电池技术专利的使用权,并正式发布量产型氢燃料电池轿车Mirai.氢氧燃料电池是符合绿色化学理念的新型发电装置.图3为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.(1)氢氧燃料电池的能量转化主要形式是化学能→电能,在导线中电子流动方向为a→b(用a、b 和箭头表示).
(2)负极反应式为H2-2e-+2OH-=2H2O.
(3)电极表面镀铂粉的原因为增大电极单位面积吸附H2和O2的分子数,增大反应速率.
(4)氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术.有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气.光伏发电是当今世界利用太阳能最主要方式之一.图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2](C为+4价)的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).

①图1中N型半导体为负极(填“正极”或“负极”)
②该系统工作时,A极的电极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O
③若A极产生7.00g N2,则此时B极产生16.8L H2(标况下).
分析 (1)氢氧燃料电池属于原电池,是将化学能转化为电能的装置;燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,电子从负极沿导线流向正极;
(2)碱性氢氧燃料电池中,负极上氢气失电子和氢氧根离子反应生成水;
(3)反应物接触面积越大,反应速率越快;
(4)该电池反应时中,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,所以生成氮气的电极A是阳极,生成氢气的电极B是阴极,结合电解池的工作原理分析解答.
解答 解:(1)氢氧燃料电池属于原电池,是将化学能转化为电能的装置,所以该燃料电池中能量主要转化形式是化学能转化为电能;燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,电子从负极沿导线流向正极,所以通入氢气的电极是负极、通入氧气的电极是正极,电子流动方向为a到b,
故答案为:化学能→电能;a→b;
(2)碱性氢氧燃料电池中,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2-2e-+2OH-=2H2O,故答案为:H2-2e-+2OH-=2H2O;
(3)反应物接触面积越大,反应速率越快,电极表面镀铂粉能增大反应物的接触面积,所以能增大反应速率,故答案为:增大电极单位面积吸附H2和O2的分子数,增大反应速率;
(4)①该电池反应时中,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,则氮元素被氧化,氢元素被还原,所以生成氮气的电极A是阳极,生成氢气的电极B是阴极,则图1中N型半导体为负极,P型半导体为正极,故答案为:负极;
②A极为阳极,电极反应式为:CO(NH2)2+80H--6e-═CO32-+N2↑+6H2O,故答案为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O;
③A极为阳极,电极反应式为:CO(NH2)2+80H--6e-═CO32-+N2↑+6H2O,若A极产生7.00g即0.25molN2,则转移电子是1.5mol,此时B极产生氢气,B电极反应为:2H2O+2e-═H2↑+2OH-,转移1.5mol电子,产生氢气的体积是:$\frac{1.5mol}{2}×22.4L/mol$=16.8L,故答案为:16.8.
点评 本题考查了原电池和电解池的工作原理知识,明确元素化合价变化与阴阳极的关系是解本题关键,根据电解池的工作原理来分析解答,难度中等.

| A. | Fe与稀HNO3 | B. | Na2O2与CO2 | ||
| C. | NaOH溶液与CO2 | D. | AlCl3溶液与NaOH溶液 |
| A. | 医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于水 | |
| B. | 红葡萄酒营养丰富(含葡萄糖、维生素C等),常添加微量的二氧化硫,利用二氧化硫还原性,防止红葡萄酒中某营养成分被氧化 | |
| C. | 某雨水放置一段时间后pH由4.68变为4.28,因为水中亚硫酸被空气中氧气氧化成硫酸 | |
| D. | 次氯酸钠溶液可用于环境的消毒杀菌 |

| A. | 分离Na2CO3溶液和CH3COOC2H5,选④ | B. | 用CCl4提取碘水中的碘,选③ | ||
| C. | 用溴水除去甲烷中混有的乙烯,选⑤ | D. | 粗盐提纯,选①和② |
| A. | 18.6g | B. | 20g | C. | 19.4g | D. | 24g |
| 实验 | 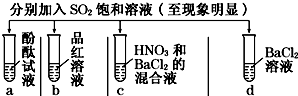 | ||||
| 记录 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色溶液 | |
| C | 无色 | 无色 | 白色沉淀 | 无色溶液 | |
| D | 无色 | 无色 | 无色沉淀 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
 表示的有机物共有(不考虑立体异构体)( )
表示的有机物共有(不考虑立体异构体)( )| A. | 9种 | B. | 12种 | C. | 24种 | D. | 36种 |
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属是K,非金属性最强的元素是F.(填写元素符号)
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物对应水化物反应的化学方程式:2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O、Al(OH)3+KOH═KAlO2+2H2O.
(4)⑨最高价氧化物对应水化物的电子式
 .
.(5)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:将氯水加入溴化钠溶液中,溶液颜色加深或溶液变为橙黄色,证明有单质Br2生成,从而证明单质氯比单质溴氧化性强.