题目内容
16.下列离子方程式正确的是( )| A. | 鸡蛋壳浸泡在盐酸中产生气泡:CO32-+2H+═CO2↑+H2O | |
| B. | 将氨气通入硫酸溶液中:NH3+H+═NH4+ | |
| C. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 向碳酸氢铵溶液中加入足量的NaOH溶液:NH4++OH-═NH3•H2O |
分析 A.碳酸钙为沉淀,应保留化学式;
B.二者反应生成硫酸铵;
C.不符合反应客观事实;
D.氢氧化钠过量,碳酸氢根离子、铵根离子都反应;
解答 解;A.鸡蛋壳浸泡在盐酸中产生气泡,离子方程式:CaCO3+2H+═CO2↑+H2O+Ca2+,故A错误;
B.将氨气通入硫酸溶液中,离子方程式:NH3+H+═NH4+,故B正确;
C.将铁粉加入稀硫酸中,离子方程式:Fe+2H+=Fe2++H2↑,故C错误;
D.向碳酸氢铵溶液中加入足量的NaOH溶液,离子方程式:HCO3-+NH4++2OH-═NH3•H2O+H2O+CO32-,故D错误;
故选:B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,明确离子反应实质及离子方程式书写方法是解题关键,题目难度不大,注意化学式的拆分、反应物用量对反应的影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.1.52g铜镁合金完全溶解于足量的浓硝酸中,得到NO2气体1344mL (标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,发现金属离子全部沉淀,下列说法不正确的是( )
| A. | 该合金中铜与镁的物质的量之比是2:1 | |
| B. | 可得到2.54 g沉淀 | |
| C. | 如果是铜铝合金,则产生的NO2 的体积不会是1344mL | |
| D. | 恰好全部沉淀时,加入NaOH溶液的体积是600 mL |
4.在隔绝空气的情况下,9.2g铁、镁、铝混合物溶解在一定量某浓度的稀硝酸中,当金属完全溶解后收集到4.48L(标准状况下)NO气体.在反应后的溶液中加入足量的烧碱溶液,可生成可生成氢氧化物的质量为( )
| A. | 18.6g | B. | 20g | C. | 19.4g | D. | 24g |
11.下列有关SO2的性质的探究实验报告记录的实验现象正确的是( )
| 实验 | 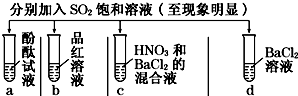 | ||||
| 记录 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色溶液 | |
| C | 无色 | 无色 | 白色沉淀 | 无色溶液 | |
| D | 无色 | 无色 | 无色沉淀 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
1.2014年12月科学家发现了迄今为止最轻的冰--“冰十六”,它是水的一种结晶形式,有着像笼子一样、可以困住其他分子的结构.下列有关叙述中不正确的是( )
| A. | “冰十六”的密度比液态水小 | B. | “冰十六”与干冰由不同分子构成 | ||
| C. | “冰十六”可以包合气体分子 | D. | 液态水转变成“冰十六”是化学变化 |
8.组成和结构可用 表示的有机物共有(不考虑立体异构体)( )
表示的有机物共有(不考虑立体异构体)( )
 表示的有机物共有(不考虑立体异构体)( )
表示的有机物共有(不考虑立体异构体)( )| A. | 9种 | B. | 12种 | C. | 24种 | D. | 36种 |
5.从降低成本和减少环境污染的角度考虑,制取硝酸铜最好的方法是( )
| A. | 铜和浓硝酸反应 | |
| B. | 铜和稀硝酸反应 | |
| C. | 铜与空气中氧气反应得氧化铜,然后氧化铜和硝酸反应 | |
| D. | 铜和硝酸银反应 |
6.下列有关化学用语正确的是( )
| A. | N2的电子式:N??N | |
| B. | 质子数为53,中子数为78的碘原子:78131I | |
| C. | S2-的结构示意图: | |
| D. | 硫酸铁的电离方程式:Fe2(SO4)3=Fe3++SO42- |