题目内容
13.A为分子式为C7H8的芳香烃根据下面的反应路线及所给信息填空.
(1)A的名称是甲苯.
(2)①的反应类型是加成反应;③的反应类型是消去反应.
(3)简述B中卤素原子的检验方法取少量B溶液于试管中,加NaOH溶液加热,一段时间后,加入足量HNO3酸化,再加Ag NO3,若产生淡黄色沉淀则为溴元素
(4)反应①的化学方程式是
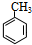 +Br2$\stackrel{光照}{→}$
+Br2$\stackrel{光照}{→}$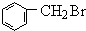 +HBr
+HBr反应③的化学方程式是
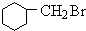 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$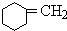 +NaBr+H2O
+NaBr+H2O反应④的化学方程式是
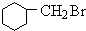 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$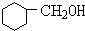 +NaBr.
+NaBr.
分析 A为分子式为C7H8的芳香烃,则A为 ,反应①为甲苯在光照条件下发生甲基上的取代反应,反应②发生苯环与氢气的加成反应,反应③为醇的消去反应,反应为卤代烃发生水解反应,可推知B为
,反应①为甲苯在光照条件下发生甲基上的取代反应,反应②发生苯环与氢气的加成反应,反应③为醇的消去反应,反应为卤代烃发生水解反应,可推知B为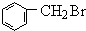 ,C为
,C为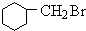 ,D为
,D为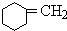 ,E为
,E为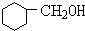 .
.
解答 解:A为分子式为C7H8的芳香烃,则A为 ,反应①为甲苯在光照条件下发生甲基上的取代反应,反应②发生苯环与氢气的加成反应,反应③为醇的消去反应,反应为卤代烃发生水解反应,可推知B为
,反应①为甲苯在光照条件下发生甲基上的取代反应,反应②发生苯环与氢气的加成反应,反应③为醇的消去反应,反应为卤代烃发生水解反应,可推知B为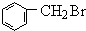 ,C为
,C为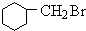 ,D为
,D为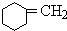 ,E为
,E为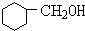 .
.
(1)A的名称是甲苯,故答案为:甲苯;
(2)①的反应类型是:取代反应.③的反应类型是消去反应,故答案为:取代反应;消去反应;
(3)B(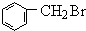 )中卤素原子的检验方法:取少量B溶液于试管中,加NaOH溶液加热,一段时间后,加入足量HNO3酸化,再加Ag NO3,若产生淡黄色沉淀则为溴元素,
)中卤素原子的检验方法:取少量B溶液于试管中,加NaOH溶液加热,一段时间后,加入足量HNO3酸化,再加Ag NO3,若产生淡黄色沉淀则为溴元素,
故答案为:取少量B溶液于试管中,加NaOH溶液加热,一段时间后,加入足量HNO3酸化,再加Ag NO3,若产生淡黄色沉淀则为溴元素;
(4)反应①的化学方程式是: +Br2$\stackrel{光照}{→}$
+Br2$\stackrel{光照}{→}$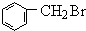 +HBr,
+HBr,
反应③的化学方程式是: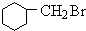 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$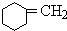 +NaBr+H2O,
+NaBr+H2O,
反应④的化学方程式是: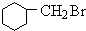 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$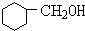 +NaBr,
+NaBr,
故答案为: +Br2$\stackrel{光照}{→}$
+Br2$\stackrel{光照}{→}$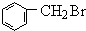 +HBr;
+HBr;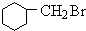 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$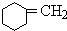 +NaBr+H2O;
+NaBr+H2O;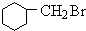 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$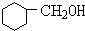 +NaBr.
+NaBr.
点评 本题考查有机物的推断,涉及芳香烃、卤代烃的性质与转化,注意根据反应条件判断发生的反应,熟练掌握官能团的性质与转化.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.25°C时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )
| A. | 将纯水加热到950C时,Kw变大,pH不变,水仍呈中性 | |
| B. | 向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 | |
| C. | 向水中加入少量固体硫酸氢钠,c(H+)增大,平衡逆向移动,KW不变 | |
| D. | 向水中通入HCl气体,平衡逆向移动,溶液导电能力减弱 |
4.在隔绝空气的情况下,9.2g铁、镁、铝混合物溶解在一定量某浓度的稀硝酸中,当金属完全溶解后收集到4.48L(标准状况下)NO气体.在反应后的溶液中加入足量的烧碱溶液,可生成可生成氢氧化物的质量为( )
| A. | 18.6g | B. | 20g | C. | 19.4g | D. | 24g |
1.2014年12月科学家发现了迄今为止最轻的冰--“冰十六”,它是水的一种结晶形式,有着像笼子一样、可以困住其他分子的结构.下列有关叙述中不正确的是( )
| A. | “冰十六”的密度比液态水小 | B. | “冰十六”与干冰由不同分子构成 | ||
| C. | “冰十六”可以包合气体分子 | D. | 液态水转变成“冰十六”是化学变化 |
8.组成和结构可用 表示的有机物共有(不考虑立体异构体)( )
表示的有机物共有(不考虑立体异构体)( )
 表示的有机物共有(不考虑立体异构体)( )
表示的有机物共有(不考虑立体异构体)( )| A. | 9种 | B. | 12种 | C. | 24种 | D. | 36种 |
18.下列表述正确的是( )
| A. | c(OH-)/c(H+)=10-12的溶液中:NH4+、Cu2+、NO3-、Cl-不能大量共存 | |
| B. | 通入过量SO2气体的溶液中:HSO3-、NO3-、Ba2+不能大量共存 | |
| C. | 向足量NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液的离子方程式为:HCO3-+Ba2++H++SO42-═BaSO4↓+H2O+CO2↑ | |
| D. | 向Fe(NO3)3溶液中加入HI溶液的离子方程式为:2Fe3++2I-═2Fe2++2I2 |
5.从降低成本和减少环境污染的角度考虑,制取硝酸铜最好的方法是( )
| A. | 铜和浓硝酸反应 | |
| B. | 铜和稀硝酸反应 | |
| C. | 铜与空气中氧气反应得氧化铜,然后氧化铜和硝酸反应 | |
| D. | 铜和硝酸银反应 |
2.短周期主族元素M、N、R、T的原子半径与族序数关系如图所示,下列推断不正确的是( )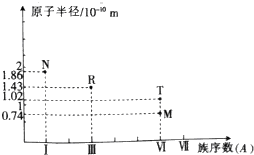

| A. | 常压下,单质R的熔点高于单质M的熔点 | |
| B. | R、T的简单离子都会破坏水的电离平衡 | |
| C. | N2M2与R2M3中所含化学键的类型完全相同 | |
| D. | N、R、T的最高价氧化物对应的水化物之间能相互反应 |
3. 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
操作如下:
①在50mL三颈烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计以及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10%Na2CO3溶液洗涤,
再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得到15.1g乙酸正丁
酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填“a”或“b”)端管口通入.
(2)三颈烧瓶中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(3)步骤①“不断分离除去反应生成的水”该操作的目的是使用分水器分离出水,使平衡正向移动,提高反应产率.
(4)步骤②中用10%Na2CO3溶液洗涤有机层,该操作的目的是除去产品中含有的乙酸等杂质.
(5)进行分液操作时,使用的漏斗是C(填选项).

(6)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高(填“高”或者“低”),原因是会收集到少量未反应的冰醋酸和正丁醇.
(7)该实验过程中,生成乙酸正丁酯的产率是65%.
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在50mL三颈烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计以及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10%Na2CO3溶液洗涤,
再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得到15.1g乙酸正丁
酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填“a”或“b”)端管口通入.
(2)三颈烧瓶中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(3)步骤①“不断分离除去反应生成的水”该操作的目的是使用分水器分离出水,使平衡正向移动,提高反应产率.
(4)步骤②中用10%Na2CO3溶液洗涤有机层,该操作的目的是除去产品中含有的乙酸等杂质.
(5)进行分液操作时,使用的漏斗是C(填选项).

(6)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高(填“高”或者“低”),原因是会收集到少量未反应的冰醋酸和正丁醇.
(7)该实验过程中,生成乙酸正丁酯的产率是65%.