题目内容
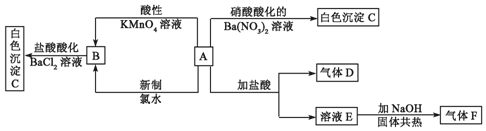
18.某课外小组设计了如图所示的实验装置(图中固定装置已略去),进行SO2性质的研究.
(1)从物质分类的角度,SO2属于酸性(填“酸性”或“碱性”)氧化物.写出硫酸型酸雨形成的反应方程式:SO2+H2O=H2SO3,2H2SO3+O2=2H2SO4.
①图中D装置可用来验证SO2具有该性质,其中所加入的试剂是滴加酚酞的NaOH稀溶液.
②当向该装置通入SO2时,A中紫色石蕊溶液变红,用化学用语解释其原因是H2O+SO2?H2SO3
(2)从元素化合价的角度分析SO2的性质.
①当向该装置通入SO2一段时间后,可观察C中溶液褪色,MnO4-转化为Mn2+,说明SO2具有还原 性,反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H +
②如验证SO2还具有另一方面的性质,可选择的药品是D.A.过氧化氢 B.浓硫酸 C.氯水 D.硫化钠溶液.
分析 (1)二氧化硫为酸性氧化物,可在A中使石蕊试液变红色,二氧化硫具有漂白性,B中品红褪色,具有还原性,可在C中与高锰酸钾发生氧化还原反应,高锰酸钾溶液褪色,检验二氧化硫的酸性,可在D中用滴加酚酞的NaOH稀溶液检验,E应为尾气处理装置;
(2)从元素化合价的角度分析SO2的性质,二氧化硫中S元素化合价为+4价,具有还原性和氧化性,可与高锰酸钾、硫化钠等溶液反应,以此解答该题.
解答 解:(1)二氧化硫能和碱反应生成盐和水,属于酸性氧化物;SO2溶于水生成亚硫酸,亚硫酸不稳定易被氧化生成硫酸,从而形成酸雨,化学方程式可表示为SO2+H2O=H2SO3,2H2SO3+O2=2H2SO4,
故答案为:酸性;SO2+H2O=H2SO3; 2H2SO3+O2=2H2SO4;
①能和碱反应生成盐和水的氧化物是酸性氧化物,因此要验证二氧化硫属于酸性氧化物,必须和碱反应,例如二氧化硫和氢氧化钠溶液反应生成亚硫酸钠和水.但亚硫酸钠溶液和氢氧化钠溶液都是无色溶液,不能观察到明显的实验现象,所以可向溶液中加入酚酞试液检验亚硫酸钠的生成,即D中盛放的液体是滴加酚酞的氢氧化钠稀溶液,故答案为:滴加酚酞的NaOH稀溶液;
②二氧化硫和水反应生成亚硫酸,反应方程式为H2O+SO2?H2SO3.亚硫酸能电离出氢离子而使其溶液呈酸性,酸能使紫色石蕊试液变红色,
故答案为:H2O+SO2?H2SO3;
(2)二氧化硫中硫元素的化合价为+4价,处于中间价态,既有氧化性也有还原性.
①酸性高锰酸钾具有强氧化性,能氧化二氧化硫生成硫酸,反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H +,
故答案为:还原;5SO2+2MnO4 -+2H2O=5SO4 2-+2Mn2++4H +;
②要证明二氧化硫的氧化性,则必须和还原性物质发生氧化还原反应.
A.过氧化氢具有氧化性,能氧化二氧化硫,故A错误;
B.浓硫酸具有强氧化性,且和二氧化硫不反应,故B错误;
C.氯水具有强氧化性,能氧化二氧化硫,故C错误;
D.硫化钠具有还原性,能被二氧化硫氧化生成单质S,因此可以验证SO2的氧化性,故D正确,
故答案为:D.
点评 本题考查性质实验方案设计,为高频考点,侧重考查学生的分析能力和实验能力,明确实验原理及物质性质、检验方法是解本题关键,知道各个装置的作用及实验现象,题目难度中等.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案 298K时,向20.00mL0.1mol/LHR溶液中滴加等浓度的NaOH 溶液,反应后溶液的pH与滴加的NaOH 溶液体积(V)的关系如图所示.下列说法正确的是( )
298K时,向20.00mL0.1mol/LHR溶液中滴加等浓度的NaOH 溶液,反应后溶液的pH与滴加的NaOH 溶液体积(V)的关系如图所示.下列说法正确的是( )| A. | HR溶液中只含有一种分子和三种离子 | |
| B. | 在①②③点对于的溶液中,②点水的电离程度最大 | |
| C. | ③点对应的溶液中有c(R-)>c(Na+)>c(H+)>c(OH-) | |
| D. | ①点对应的溶液中R-的水解程度小于HR的电离程度 |

| A. | H2R是二元弱酸,其Ka1=1×10-2 | |
| B. | NaHR在溶液中水解程度小于电离程度 | |
| C. | pH<7.2的溶液中一定存在:c( Na+)>c( HR-)>c(R2-)>c(H+)>c(OH-) | |
| D. | 含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2 |
| A. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则C(碳)的燃烧热为-110.5 kJ•mol-1 | |
| B. | 在101KPa下氢气的燃烧热△H=-285.5 kJ•mol-1,则水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 已知中和热△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量为57.3 kJ | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出热量28.7 kJ,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4 kJ•mol-1 |
| 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 | |
| ① | Cl2 | FeBr2 | Cl- | ||
| ② | KClO3 | 浓盐酸 | Cl2 | ||
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 氧化性强弱的比较:KClO3<Cl2 | |
| B. | 第②组事实可以推测:ClO-、Cl-不能在溶液中大量共存 | |
| C. | 第①组的反应,当Cl2与FeBr2物质的量之比≤1:2时,只有一种元素被氧化 | |
| D. | 第③组反应的离子方程式为:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
 ;F的结构式
;F的结构式 ;
;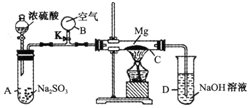 按如图装置进行如下实验,请用你所学知识完成下题:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发生耀眼白光,产生白烟,管壁上附有淡黄色物质.实验完成后将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成.
按如图装置进行如下实验,请用你所学知识完成下题:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发生耀眼白光,产生白烟,管壁上附有淡黄色物质.实验完成后将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成.