题目内容
8.钴及其合金在电机、机械、化工、航空和航天等工业部门得到广泛的应用,并成为一种重要的战略金属.Ⅰ.钴酸锂电池的正极采用钴酸锂LiCoO2,负极采用金属锂和碳的复合材料,该电池的反应为:LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6,写出放电时负极的电极反应LixC6-xe-=6C+xLi+.
Ⅱ.碱式碳酸钴[Cox(OH)y(CO3)z]常用做电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图(甲、乙、丙)所示的装置进行实验.

实验步骤如下:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,检查装置气密性;
③加热玻璃管,当乙装置中不再有气泡产生,停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(1)从下列图示(A-D)选出合理的装置填入方框中,使整套实验装置完整(选填字母序号,可重复选用):
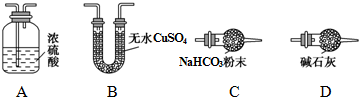
甲D;乙A;丙D.
甲装置的作用是吸收空气中的H2O和CO2,减少实验误差.
(2)补充完整步骤③不再有气泡产生;步骤④中缓缓通入空气数分钟的目的是将生成的CO2和H2O全部赶入乙和丙吸收.
(3)若按正确装置进行实验,测得如下数据:
| 乙装置的质量(g) | 丙装置的质量(g) | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
(4)为了比较亚硫酸和碳酸的酸性强弱,某同学用如下(A、B)装置进行实验:

①试剂A是酸性高锰酸钾溶液,试剂B是澄清石灰水.
②若将SO2通入水中至饱和,请设计实验证明亚硫酸是弱酸:首先测得亚硫酸饱和溶液的pH,然后取一定体积的饱和溶液稀释10倍再测pH,若pH差小于1,说明亚硫酸是弱酸用中和滴定法,根据氢氧化钠溶液的体积可知溶液中亚硫酸的浓度,比较亚硫酸的浓度和氢离子的浓度,若亚硫酸的浓度大于氢离子的浓度,则亚硫酸为弱酸.
分析 Ⅰ.放电时,负极上失电子化合价升高,发生氧化反应;
Ⅱ.(1)受热时可分解生成三种氧化物,利用空气先通过装置D干燥管中的碱石灰除去空气中的二氧化碳和水蒸气,剩余气体把生成的水蒸气和二氧化碳赶入装置乙和丙完全吸收,玻璃管中加热分解碱式碳酸钴[Cox(OH)y(CO3)z],生成气体通过装置A中的浓硫酸吸收水蒸气测定生成水的质量,通过装置D中碱石灰吸收生成的二氧化碳气体测定生成二氧化碳的质量,最后的碱石灰干燥管防止空气中的二氧化碳和水蒸气进入装置丙影响测定结果;
(2)加热甲中玻璃管,当乙装置中不再有气泡产生,即碱式碳酸钴分解完毕,步骤④中缓缓通入空气数分钟,将装置中生成的CO2和H2O全部排入乙、丙装置中,以免影响测量结果;
(3)碱式碳酸钴样品3.65g,反应前乙装置的质量为80.00g,反应后质量为80.36g,故生成水的质量为80.36g-80.00g=0.36g,物质的量为$\frac{0.36g}{18g/mol}$=0.02mol;反应前丙装置的质量为62.00g,反应后质量为62.88g,生成二氧化碳的质量为62.88g-62.00g=0.88g,物质的量为$\frac{0.88g}{44g/mol}$=0.02mol,故Co的质量为3.65g-0.02mol×2×17g/mol-0.02mol×60g/mol=1.77g,故Co原子物质的量为:$\frac{1.77g}{59g/mol}$=0.03mol,根据Co、H、C元素守恒可知,x:y:z=0.03mol:0.02mol×2:0.02mol=3:4:2,得到化学式;
(4)根据装置图可知,二氧化硫通入碳酸氢钠溶液中能产生二氧化碳,通过高锰酸钾溶液,二氧化硫被吸收,品红可以检验二氧化硫被吸收干净,再通过澄清石灰水,石灰水变混浊,说明在碳酸氢钠溶液中有二氧化碳产生;用pH计可测定溶液中氢离子的浓度,用中和滴定法,根据氢氧化钠溶液的体积可知溶液中亚硫酸的浓度,比较亚硫酸的浓度和氢离子的浓度可知亚硫酸是否完全电离,据此答题;
解答 解:Ⅰ.钴酸锂电池的正极采用钴酸锂LiCoO2,负极采用金属锂和碳的复合材料,放电时,根据电池反应式知,负极反应式为LixC6-xe-=6C+xLi+、正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,
故答案为:LixC6-xe-=6C+xLi+;
Ⅱ.(1)利用空气先通过装置D干燥管中的碱石灰除去空气中的二氧化碳和水蒸气,剩余气体把生成的水蒸气和二氧化碳赶入装置乙和丙完全吸收,玻璃管中加热分解碱式碳酸钴[Cox(OH)y(CO3)z],生成气体通过装置A中的浓硫酸吸收水蒸气测定生成水的质量,通过装置D中碱石灰吸收生成的二氧化碳气体测定生成二氧化碳的质量,最后的碱石灰干燥管防止空气中的二氧化碳和水蒸气进入装置丙影响测定结果,甲装置的作用是 吸收空气中的H2O和CO2,减少实验误差,
故答案为:D A D; 吸收空气中的H2O和CO2,减少实验误差;
(2)③加热玻璃管,当乙装置中不再有气泡产生,即碱式碳酸钴分解完毕,步骤④中缓缓通入空气数分钟,将装置中生成的CO2和H2O全部排入乙、丙装置中,以免影响测量结果,
故答案为:不再有气泡产生,将生成的CO2和H2O全部赶入乙和丙吸收;
(3)碱式碳酸钴样品3.65g,反应前乙装置的质量为80.00g,反应后质量为80.36g,故生成水的质量为80.36g-80.00g=0.36g,物质的量为$\frac{0.36g}{18g/mol}$=0.02mol;反应前丙装置的质量为62.00g,反应后质量为62.88g,生成二氧化碳的质量为62.88g-62.00g=0.88g,物质的量为$\frac{0.88g}{44g/mol}$=0.02mol,故Co的质量为3.65g-0.02mol×2×17g/mol-0.02mol×60g/mol=1.77g,故Co原子物质的量为:$\frac{1.77g}{59g/mol}$=0.03mol,根据Co、H、C元素守恒可知,x:y:z=0.03mol:0.02mol×2:0.02mol=3:4:2,故碱式碳酸钴的化学式为Co3(OH)4(CO3)2;
故答案为:Co3(OH)4(CO3)2;
(4)①根据装置图可知,二氧化硫通入碳酸氢钠溶液中能产生二氧化碳,通过装置A中高锰酸钾溶液,二氧化硫被吸收,品红可以检验二氧化硫被吸收干净,再通过装置B中澄清石灰水,石灰水变混浊,说明在碳酸氢钠溶液中有二氧化碳产生,所以该实验的实验目的为比较亚硫酸与碳酸酸性的强弱,
故答案为:酸性高锰酸钾溶液; 澄清石灰水;
②证明亚硫酸是弱电解质的实验方案为:用pH计可测定溶液中氢离子的浓度,然后取一定体积的饱和溶液稀释10倍再测pH,若pH差小于1,说明亚硫酸是弱酸或用中和滴定法,根据氢氧化钠溶液的体积可知溶液中亚硫酸的浓度,比较亚硫酸的浓度和氢离子的浓度,若亚硫酸的浓度大于氢离子的浓度,则亚硫酸为弱酸,
故答案为:首先测得亚硫酸饱和溶液的pH,然后取一定体积的饱和溶液稀释10倍再测pH,若pH差小于1,说明亚硫酸是弱酸或用中和滴定法,根据氢氧化钠溶液的体积可知溶液中亚硫酸的浓度,比较亚硫酸的浓度和氢离子的浓度,若亚硫酸的浓度大于氢离子的浓度,则亚硫酸为弱酸;
点评 本题考查学生对实验原理理解、方案设计的评价、实验装置的理解、物质组成的测定等,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具有扎实的基础与综合运用分析解决问题的能力.

 名校课堂系列答案
名校课堂系列答案| A. | 热稳定性:HCl>HI | B. | 沸点:H2O<H2S<H2Se | ||
| C. | 酸性:HClO4>H2SO4. | D. | 离子半径:N3->O2->F- |
| A. | 不锈钢、黄铜 | B. | 24K金、铜导线 | C. | 生铁、钢 | D. | 钱币、铜钟 |
| A. | Cu2++2OH-→Cu(OH)2↓ 3CuSO4+2Fe(OH)3→Fe2(SO4)3+3Cu(OH)2↓ | |
| B. | S2-+2Ag+→Ag2S↓ H2S+2AgNO3→Ag2S↓+2HNO3 | |
| C. | CO32-+2H+→H2O+CO2↑ Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑ | |
| D. | Ag++Cl-=AgCl↓ AgNO3+NaCl=NaNO3+AgCl↓ |
 ,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是
,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是 .
.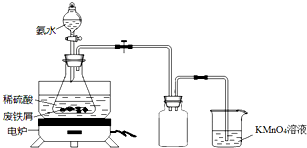 某实验小组用废铁屑(含少量S等元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体[K3Fe(C2O4)3•3H2O]并测定其组成.
某实验小组用废铁屑(含少量S等元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体[K3Fe(C2O4)3•3H2O]并测定其组成.
 周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.请回答下列问题:
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.请回答下列问题: 与1-己炔 ⑦
与1-己炔 ⑦ 和
和 ⑧
⑧ 和
和
 、C的结构简式:CH2=CH-CH=CH2、E的键线式:
、C的结构简式:CH2=CH-CH=CH2、E的键线式: .
.