题目内容
19.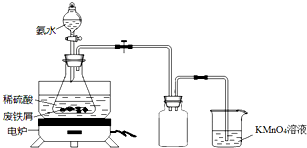 某实验小组用废铁屑(含少量S等元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体[K3Fe(C2O4)3•3H2O]并测定其组成.
某实验小组用废铁屑(含少量S等元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体[K3Fe(C2O4)3•3H2O]并测定其组成.实验一 制备硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]
小组同学设计如图装置(夹持仪器略去),称取一定量废铁屑于锥形瓶中,加入适量稀硫酸,在通风橱中置于50~60℃热水浴中加热,充分反应.待锥形瓶中溶液冷却后加入氨水,搅拌使其反应完全,制得浅绿色悬浊液.
(1)实验室保存浓氨水的方法是密封保存,置于冷暗处.
(2)烧杯中高锰酸钾溶液的作用是吸收H2S等尾气,防止污染空气.
(3)写出锥形瓶中发生中和反应的离子方程式:NH3•H2O+H+=NH4++H2O.
(4)若要确保获得浅绿色悬浊液,实验过程应注意的是ab(填序号).
a.保持铁屑过量 b.控制溶液呈强酸性 c.持续升高温度
实验二 制备三草酸合铁(Ⅲ)酸钾晶体
实验小组用实验一锥形瓶中的悬浊液设计以下实验流程制备三草酸合铁(Ⅲ)酸钾晶体.

已知:25℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq)?[Fe(SCN)]2+(aq)+3C2O42-(aq) K=10-16.2
(5)写出步骤Ⅰ生成黄色沉淀(FeC2O4•2H2O)的化学方程式:(NH4)2SO4•FeSO4•6H2O+H2C2O4=FeC2O4•2H2O↓+(NH4)2SO4+H2SO4+4H2O.
(6)步骤Ⅱ水浴加热需控制40℃的理由是温度太高,H2O2分解;温度太低,Fe2+氧化速度太慢.
(7)小组同学欲检验晶体中含有Fe(Ⅲ),取少量晶体放入试管中,用蒸馏水充分溶解,向试管中滴入几滴0.1mol•L-1KSCN溶液.请判断上述实验方案是否可行并说明理由.否,因为[Fe(C2O4)3]3-转化为[Fe(SCN)]2+反应的平衡常数小于10-5,观察不到明显现象,所以无法检验.
实验三 测定三草酸合铁(Ⅲ)酸钾晶体中C2O42-的含量
小组同学准确称取m g晶体配制成250mL溶液,取25mL该溶液于锥形瓶中,加入3mol•L-1硫酸溶液10mL,滴入二苯胺磺酸钠作指示剂,用c mol•L-1K2Cr2O7标准液滴定至紫红色,平行实验三次,平均消耗标准液V mL.已知:Cr2O72-在酸性介质中被还原为Cr3+.
(8)晶体中C2O42-质量分数的表达式为$\frac{264cV}{m}%$.
分析 (1)氨水不稳定,见光受热易分解,需密封、冷暗处保存;
(2)由于废铁屑中含有含S元素的物质,加入稀硫酸,会产生硫化氢等有毒气体,不能向空气中排放;
(3)稀硫酸与氨水的反应,生成硫酸铵和水,氨水为弱碱,不能拆;
(4)由于Fe2+有较强的还原性,为弱碱阳离子,实验过程中要防止二价铁被氧气氧化和水解;
(5)步骤Ⅰ为硫酸亚铁铵晶体与饱和草酸溶液反应生成黄色沉淀(FeC2O4•2H2O,据此写出方程式;
(6)温度太高,H2O2分解;温度太低,Fe2+氧化速度太慢;
(7)因为25℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq)?[Fe(SCN)]2+(aq)+3C2O42-(aq) K=10-16.2,平衡常数小于10-5,离子浓度太小,观察不到明显现象,所以无法检验;
(8)根据方程式3C2O42-+14H++Cr2O72-=2Cr3++6CO2↑+7H2O进行计算,注意250mL中取25mL,但计算的是原晶体中的含量.
解答 解:(1)由于氨水不稳定,见光受热易分解,故实验室保存氨水的方法为密封保存,置于冷暗处,故答案为:密封保存,置于冷暗处;
(2)由于废铁屑中含有含S元素的物质,加入稀硫酸,会产生硫化氢等有毒气体,不能向空气中排放,高锰酸钾溶液的作用是吸收H2S等尾气,防止污染空气,故答案为:吸收H2S等尾气,防止污染空气;
(3)锥形瓶中是冷切后的溶液中稀硫酸与氨水的反应,生成硫酸铵和水,氨水为弱碱,不能拆,离子方程式为NH3•H2O+H+=NH4++H2O,故答案为:NH3•H2O+H+=NH4++H2O;
(4)由于Fe2+有较强的还原性,实验过程中要防止二价铁被氧气氧化,保持铁屑过量就是防止亚铁离子被氧化;二价铁离子在溶液中要水解,故需抑制其水解,加入稀硫酸可以增大氢离子浓度,抑制亚铁离子的水解,因此要确保获得浅绿色悬浊液,可选择ab,故答案为:ab;
(5)步骤Ⅰ为硫酸亚铁铵晶体与饱和草酸溶液反应生成黄色沉淀(FeC2O4•2H2O),化学方程式为(NH4)2SO4•FeSO4•6H2O+H2C2O4=FeC2O4•2H2O↓+(NH4)2SO4+H2SO4+4H2O,故答案为:(NH4)2SO4•FeSO4•6H2O+H2C2O4=FeC2O4•2H2O↓+(NH4)2SO4+H2SO4+4H2O;
(6)温度太高,H2O2分解;温度太低,Fe2+氧化速度太慢,故水浴加热控制在40℃是防止过氧化氢分解和确保二价铁被氧化为三价铁的反应速率,故答案为:温度太高,H2O2分解;温度太低,Fe2+氧化速度太慢;
(7)因为25℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq)?[Fe(SCN)]2+(aq)+3C2O42-(aq) K=10-16.2,平衡常数小于10-5,离子浓度太小,观察不到明显现象,所以无法检验,故答案为:否,因为[Fe(C2O4)3]3-转化为[Fe(SCN)]2+反应的平衡常数小于10-5,观察不到明显现象,所以无法检验;
(8)根据反应,25mL标准液消耗c mol•L-1K2Cr2O7V mL,物质的量为cV×10-3mol,设有C2O42-的质量为x,根据方程式
3C2O42-+14H++Cr2O72-=2Cr3++6CO2↑+7H2O
3×88g 1mol
x cV×10-3mol
x=264cV×10-3g,故250mL中含有的质量为264cV×10-2g,晶体中C2O42-质量分数的表达式为=$\frac{264cV}{m}%$,故答案为:$\frac{264cV}{m}%$.
点评 本题考查物质的制备原理和操作方法,需要学生阅读题目获取信息的能力、氧化还原反应及计算等,难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力,注意基础知识的全面掌握.

| A. | v(A)=0.3mol/(L•s) | B. | v(B)=0.6mol/(L•s) | C. | v(C)=0.4mol/(L•s) | D. | v(D)=0.45mol/(L•s) |
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(3)写出物质的电子式:①的氢化物
 .
. | A. | 14g乙烯、丙烯、丁烯的混合气体中所含原子数为3NA | |
| B. | 28g乙烯所含共用电子对数目为5NA | |
| C. | 标准状况下,11.2 L氯仿所含分子数为0.5 NA | |
| D. | 46g乙醇中含有C-H键数目为6NA |
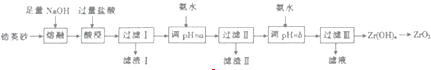
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO2,Na2ZrO2与酸反应生成ZrO2+
②部分离子在实验条件下开始沉淀和完全沉淀时的pH如表?
| 离子 | Fe3+ | AP+ | ZrO2+ |
| 开始沉淀pH | 1.9 | 3.3 | 6.2 |
| 完仝沉淀pH | 3.2 | 5.2 | 8.0 |
(2)滤渣I的主要成分的名称为硅酸
(3)向过滤Ⅰ所得溶液中加氨水调pH=a,其目的是除去Fe3+、Al3+
(4)向过滤Ⅲ所得溶液中加入CaCO2粉末并加热,可得CO2和另一种气体,该反应的离子方程式为2NH4++CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$Ca2++2NH3↑+CO2↑+H2O.
Ⅰ.钴酸锂电池的正极采用钴酸锂LiCoO2,负极采用金属锂和碳的复合材料,该电池的反应为:LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6,写出放电时负极的电极反应LixC6-xe-=6C+xLi+.
Ⅱ.碱式碳酸钴[Cox(OH)y(CO3)z]常用做电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图(甲、乙、丙)所示的装置进行实验.

实验步骤如下:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,检查装置气密性;
③加热玻璃管,当乙装置中不再有气泡产生,停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(1)从下列图示(A-D)选出合理的装置填入方框中,使整套实验装置完整(选填字母序号,可重复选用):
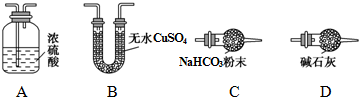
甲D;乙A;丙D.
甲装置的作用是吸收空气中的H2O和CO2,减少实验误差.
(2)补充完整步骤③不再有气泡产生;步骤④中缓缓通入空气数分钟的目的是将生成的CO2和H2O全部赶入乙和丙吸收.
(3)若按正确装置进行实验,测得如下数据:
| 乙装置的质量(g) | 丙装置的质量(g) | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
(4)为了比较亚硫酸和碳酸的酸性强弱,某同学用如下(A、B)装置进行实验:

①试剂A是酸性高锰酸钾溶液,试剂B是澄清石灰水.
②若将SO2通入水中至饱和,请设计实验证明亚硫酸是弱酸:首先测得亚硫酸饱和溶液的pH,然后取一定体积的饱和溶液稀释10倍再测pH,若pH差小于1,说明亚硫酸是弱酸用中和滴定法,根据氢氧化钠溶液的体积可知溶液中亚硫酸的浓度,比较亚硫酸的浓度和氢离子的浓度,若亚硫酸的浓度大于氢离子的浓度,则亚硫酸为弱酸.

 .其反应类型为消去反应.检验生成的乙烯要将气体先后通入氢氧化钠溶液、酸性高锰酸钾溶液或溴水中.(填试剂名称)
.其反应类型为消去反应.检验生成的乙烯要将气体先后通入氢氧化钠溶液、酸性高锰酸钾溶液或溴水中.(填试剂名称)