题目内容
13.下列有关物质性质的说法错误的是( )| A. | 热稳定性:HCl>HI | B. | 沸点:H2O<H2S<H2Se | ||
| C. | 酸性:HClO4>H2SO4. | D. | 离子半径:N3->O2->F- |
分析 A.非金属性越强,对应氢化物越稳定;
B.水中含氢键,沸点最高,同类型的分子,相对分子质量越大,沸点越大;
C.非金属性越强,对应最高价含氧酸的酸性越强;
D.具有相同电子排布的离子,原子序数大的离子半径小.
解答 解:A.非金属性Cl>I,热稳定性:HCl>HI,故A正确;
B.水中含氢键,沸点最高,同类型的分子,相对分子质量越大,沸点越大,则沸点:H2S<H2Se<H2O,故B错误;
C.非金属性Cl>S,酸性:HClO4>H2SO4,故C正确;
D.具有相同电子排布的离子,原子序数大的离子半径小,则离子半径:N3->O2->F-,故D正确;
故选B.
点评 本题考查元素周期表和周期律的综合应用,为高频考点,把握元素的性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
3. 酸性干电池装置示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )
酸性干电池装置示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )
 酸性干电池装置示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )
酸性干电池装置示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )| A. | 碳为电池的负极 | B. | 氨气在碳棒上生成 | ||
| C. | 电流由锌极流向碳极 | D. | H2在Zn片上生成 |
1.下列说法正确的是( )
| A. | 聚丙烯的结构简式为: | |
| B. | 已知:正丁烷(C4H10)的二氯代物有六种同分异构体,则它的八氯代物也有六种同分异构体 | |
| C. | 四氯化碳分子的电子式为: | |
| D. |  有7种吸收峰 有7种吸收峰 |
8.钴及其合金在电机、机械、化工、航空和航天等工业部门得到广泛的应用,并成为一种重要的战略金属.
Ⅰ.钴酸锂电池的正极采用钴酸锂LiCoO2,负极采用金属锂和碳的复合材料,该电池的反应为:LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6,写出放电时负极的电极反应LixC6-xe-=6C+xLi+.
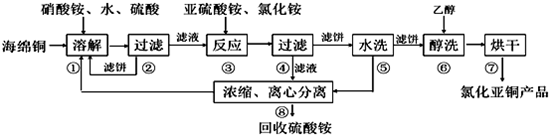
Ⅱ.碱式碳酸钴[Cox(OH)y(CO3)z]常用做电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图(甲、乙、丙)所示的装置进行实验.

实验步骤如下:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,检查装置气密性;
③加热玻璃管,当乙装置中不再有气泡产生,停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(1)从下列图示(A-D)选出合理的装置填入方框中,使整套实验装置完整(选填字母序号,可重复选用):
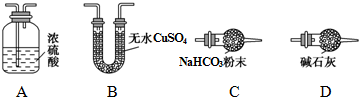
甲D;乙A;丙D.
甲装置的作用是吸收空气中的H2O和CO2,减少实验误差.
(2)补充完整步骤③不再有气泡产生;步骤④中缓缓通入空气数分钟的目的是将生成的CO2和H2O全部赶入乙和丙吸收.
(3)若按正确装置进行实验,测得如下数据:
则该碱式碳酸钴的化学式为Co3(OH)4(CO3)2.
(4)为了比较亚硫酸和碳酸的酸性强弱,某同学用如下(A、B)装置进行实验:

①试剂A是酸性高锰酸钾溶液,试剂B是澄清石灰水.
②若将SO2通入水中至饱和,请设计实验证明亚硫酸是弱酸:首先测得亚硫酸饱和溶液的pH,然后取一定体积的饱和溶液稀释10倍再测pH,若pH差小于1,说明亚硫酸是弱酸用中和滴定法,根据氢氧化钠溶液的体积可知溶液中亚硫酸的浓度,比较亚硫酸的浓度和氢离子的浓度,若亚硫酸的浓度大于氢离子的浓度,则亚硫酸为弱酸.
Ⅰ.钴酸锂电池的正极采用钴酸锂LiCoO2,负极采用金属锂和碳的复合材料,该电池的反应为:LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6,写出放电时负极的电极反应LixC6-xe-=6C+xLi+.
Ⅱ.碱式碳酸钴[Cox(OH)y(CO3)z]常用做电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图(甲、乙、丙)所示的装置进行实验.

实验步骤如下:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,检查装置气密性;
③加热玻璃管,当乙装置中不再有气泡产生,停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(1)从下列图示(A-D)选出合理的装置填入方框中,使整套实验装置完整(选填字母序号,可重复选用):

甲D;乙A;丙D.
甲装置的作用是吸收空气中的H2O和CO2,减少实验误差.
(2)补充完整步骤③不再有气泡产生;步骤④中缓缓通入空气数分钟的目的是将生成的CO2和H2O全部赶入乙和丙吸收.
(3)若按正确装置进行实验,测得如下数据:
| 乙装置的质量(g) | 丙装置的质量(g) | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
(4)为了比较亚硫酸和碳酸的酸性强弱,某同学用如下(A、B)装置进行实验:

①试剂A是酸性高锰酸钾溶液,试剂B是澄清石灰水.
②若将SO2通入水中至饱和,请设计实验证明亚硫酸是弱酸:首先测得亚硫酸饱和溶液的pH,然后取一定体积的饱和溶液稀释10倍再测pH,若pH差小于1,说明亚硫酸是弱酸用中和滴定法,根据氢氧化钠溶液的体积可知溶液中亚硫酸的浓度,比较亚硫酸的浓度和氢离子的浓度,若亚硫酸的浓度大于氢离子的浓度,则亚硫酸为弱酸.
18.在一定条件下,对于密闭容器中进行的反应:2A(g)+B(g)?C(g)+D(g),下列情况可以说明这一反应已经达到平衡状态的是( )
| A. | A、B、C、D的浓度相等 | B. | A、B、C、D在密闭容器中共存 | ||
| C. | A、B、C、D的浓度不再变化 | D. | A消耗的速率与C消耗的速率相等 |
5.A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如表所示:
请回答下列问题:
(1)A在元素周期表中的位置是第三周期第ⅡA族;A与E形成的化合物的电子式是 .
.
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+.
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(4)F的氢氧化物的是两性(填“酸性”“碱性”“两性”)氢氧化物,其电离方程式是Al3++3OH- Al(OH)3
Al(OH)3 H++AlO2-+H2O;F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
H++AlO2-+H2O;F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
| 元素 | 结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
(1)A在元素周期表中的位置是第三周期第ⅡA族;A与E形成的化合物的电子式是
 .
.(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+.
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(4)F的氢氧化物的是两性(填“酸性”“碱性”“两性”)氢氧化物,其电离方程式是Al3++3OH-
 Al(OH)3
Al(OH)3 H++AlO2-+H2O;F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
H++AlO2-+H2O;F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
2.等体积、物质的量浓度之比为6:2:3的AClx、BCly、CClz三种盐溶液分别与足量AgNO3溶液反应,生成等量沉淀,则x:y:z为( )
| A. | 1:2:3 | B. | 1:3:2 | C. | 2:4:5 | D. | 2:3:1 |
3.下列各组元素性质活原子结构递变情况错误的是( )
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增小 | |
| C. | N、O、F原子半径依次增大 | |
| D. | Na、K、Rb的电子层数依次增多 |