题目内容
18.A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的$\frac{1}{2}$,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同.B与D可以形成三原子化合物甲.A是非金属元素,且A、C、F可形成离子化合物乙.请回答:(1)C单质的电子式
 ,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是
,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是 .
.(2)化合物乙中含有的化学键是离子键、共价键、配位键
(3)化合物甲的电子式,E单质在一定条件下与甲反应的化学方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(4)ABC分子中的三个原子除A原子外均为8电子构型,写出该分子的结构式H-C≡N,根据电子云重叠方式的不同,分子里共价键的类型有σ键、π键;
(5)常温下,CA3呈气态,但易被液化,且极易溶于水,其原因是NH3分子之间存在氢键,沸点高,易液化.NH3与H2O之间易形成氢键,NH3与H2O都是极性分子,相似相溶,NH3与H2O能反应,极易溶于水;
(6)液态的 CA3是一种重要的溶剂,其性质与H2O相似,可以与活泼金属反应,写出Na与液态CA3反应的化学方程式2Na+2NH3=2NaNH2+H2↑.
分析 A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增,B原子核外最外层电子数是次外层电子数的两倍,原子只能有2个电子层,最外层电子数为4,故B为C元素;B原子电子总数是E原子总数的$\frac{1}{2}$,则E原子核外电子数为12,为Mg元素;由原子序数可知,F处于第三周期,F是同周期元素中原子半径最小的元素,则F为Cl元素;D2-与E2+的电子层结构相同,离子核外电子数为10,故D为O元素;C的原子序数介于碳、氧之间,故C为N元素;B与D可以形成三原子化合物甲为CO2;A是非金属元素,且A、C、F可形成离子化合物乙,则A为H元素,乙为NH4NO3,据此进行解答.
解答 解:A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增,B原子核外最外层电子数是次外层电子数的两倍,原子只能有2个电子层,最外层电子数为4,故B为C元素;B原子电子总数是E原子总数的$\frac{1}{2}$,则E原子核外电子数为12,为Mg元素;由原子序数可知,F处于第三周期,F是同周期元素中原子半径最小的元素,则F为Cl元素;D2-与E2+的电子层结构相同,离子核外电子数为10,故D为O元素;C的原子序数介于碳、氧之间,故C为N元素;B与D可以形成三原子化合物甲为CO2;A是非金属元素,且A、C、F可形成离子化合物乙,则A为H元素,乙为NH4NO3,
(1)C单质为N2,分子中N原子之间形成3对共用电子对,电子式为 ,F为Cl元素,Cl-的电子排布式为1s22s22p63s23p6,E为Mg元素,原子结构示意图是
,F为Cl元素,Cl-的电子排布式为1s22s22p63s23p6,E为Mg元素,原子结构示意图是 ,
,
故答案为: ;1s22s22p63s23p6;
;1s22s22p63s23p6; ;
;
(2)化合物乙为NH4NO3,含有的化学键有:离子键、共价键、配位键,
故答案为:离子键、共价键、配位键;
(3)化合物甲为CO2,二氧化碳为共价化合物,其分子式为 ;Mg在二氧化碳燃烧生成MgO与碳,反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
;Mg在二氧化碳燃烧生成MgO与碳,反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为: ;2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
;2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(4)ABC分子为HCN,分子中的三个原子除H原子外均为8电子构型,该分子的结构式为:H-C≡N,根据电子云重叠方式的不同,分子里共价键的类型有:σ键、π键,
故答案为:H-C≡N;σ键、π键;
(5)常温下,NH3呈气态,但易被液化,且极易溶于水,其原因是:NH3分子之间存在氢键,沸点高,易液化.NH3与H2O之间易形成氢键,NH3与H2O都是极性分子,相似相溶,NH3与H2O能反应,极易溶于水,
故答案为:NH3分子之间存在氢键,沸点高,易液化.NH3与H2O之间易形成氢键,NH3与H2O都是极性分子,相似相溶,NH3与H2O能反应,极易溶于水;
(6)液态的NH3是一种重要的溶剂,其性质与H2O相似,可以与活泼金属反应,Na与液态NH3反应的化学方程式为:2Na+2NH3=2NaNH2+H2↑,
故答案为:2Na+2NH3=2NaNH2+H2↑.
点评 本题考查原子结构与元素周期律的综合应用,题目难度中等,推断元素是解题关键,试题侧重对化学用语的考查,有利于基础知识的巩固,注意氢键对物质性质的影响.

| A. | 反应是吸热还是放热的,须看反应物和生成物所具有总能量的大小 | |
| B. | 放热反应在常温条件下一定很容易发生 | |
| C. | 需要加热方能发生的反应一定是吸热反应 | |
| D. | Ba(OH)2•8H2O与NH4Cl的反应为放热反应 |
| A. | v(A)=0.3mol/(L•s) | B. | v(B)=0.6mol/(L•s) | C. | v(C)=0.4mol/(L•s) | D. | v(D)=0.45mol/(L•s) |
| A. | CH3CH=CH2和  | B. | 乙炔和苯 | C. |  和 和 | D. | 葡萄糖与果糖 |
| A. | 二氧化硫气体通入硝酸钡溶液,生成白色BaSO4沉淀 | |
| B. | 氨气的水溶液可以导电,所以氨气是电解质 | |
| C. | 酸性高锰酸钾溶液中通入二氧化硫气体,溶液褪色,证明二氧化硫有漂白性 | |
| D. | 硝酸具有挥发性,所以硝酸不稳定 |
 酸性干电池装置示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )
酸性干电池装置示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )| A. | 碳为电池的负极 | B. | 氨气在碳棒上生成 | ||
| C. | 电流由锌极流向碳极 | D. | H2在Zn片上生成 |
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(3)写出物质的电子式:①的氢化物
 .
. | A. | 14g乙烯、丙烯、丁烯的混合气体中所含原子数为3NA | |
| B. | 28g乙烯所含共用电子对数目为5NA | |
| C. | 标准状况下,11.2 L氯仿所含分子数为0.5 NA | |
| D. | 46g乙醇中含有C-H键数目为6NA |
Ⅰ.钴酸锂电池的正极采用钴酸锂LiCoO2,负极采用金属锂和碳的复合材料,该电池的反应为:LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6,写出放电时负极的电极反应LixC6-xe-=6C+xLi+.
Ⅱ.碱式碳酸钴[Cox(OH)y(CO3)z]常用做电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图(甲、乙、丙)所示的装置进行实验.

实验步骤如下:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,检查装置气密性;
③加热玻璃管,当乙装置中不再有气泡产生,停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(1)从下列图示(A-D)选出合理的装置填入方框中,使整套实验装置完整(选填字母序号,可重复选用):
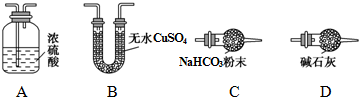
甲D;乙A;丙D.
甲装置的作用是吸收空气中的H2O和CO2,减少实验误差.
(2)补充完整步骤③不再有气泡产生;步骤④中缓缓通入空气数分钟的目的是将生成的CO2和H2O全部赶入乙和丙吸收.
(3)若按正确装置进行实验,测得如下数据:
| 乙装置的质量(g) | 丙装置的质量(g) | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
(4)为了比较亚硫酸和碳酸的酸性强弱,某同学用如下(A、B)装置进行实验:

①试剂A是酸性高锰酸钾溶液,试剂B是澄清石灰水.
②若将SO2通入水中至饱和,请设计实验证明亚硫酸是弱酸:首先测得亚硫酸饱和溶液的pH,然后取一定体积的饱和溶液稀释10倍再测pH,若pH差小于1,说明亚硫酸是弱酸用中和滴定法,根据氢氧化钠溶液的体积可知溶液中亚硫酸的浓度,比较亚硫酸的浓度和氢离子的浓度,若亚硫酸的浓度大于氢离子的浓度,则亚硫酸为弱酸.