题目内容
2.下列各物质的转化关系如图所示,其中C是一种日常生活中常见的单质,D是一种棕红色固体.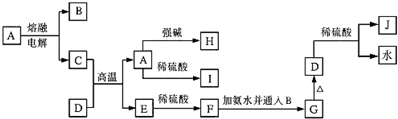
回答下列问题:
(1)C的名称为铝;J的化学式为Fe2(SO4)3.
(2)写出由A生成H的离子反应方程式:Al2O3+2OH-+3H2O=2[Al(OH)4]-.
(3)某气体能使品红溶液褪色,但加热后又恢复,该气体通入J溶液中发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
分析 C是一种日常生活中常见的单质,D是一种棕红色固体,由转化关系可知,D为Fe2O3,J为Fe2(SO4)3,G为Fe(OH)3,A为Al2O3,C为Al,B为O2,E为Fe,F为FeSO4,据此解答.
解答 解:C是一种日常生活中常见的单质,D是一种棕红色固体,由转化关系可知,D为Fe2O3,J为Fe2(SO4)3,G为Fe(OH)3,A为Al2O3,C为Al,B为O2,E为Fe,F为FeSO4.
(1)C的名称为铝,J的化学式为Fe2(SO4)3,故答案为:铝;Fe2(SO4)3;
(2)由A生成H的离子反应方程式:Al2O3+2OH-+3H2O=2[Al(OH)4]-,故答案为:Al2O3+2OH-+3H2O=2[Al(OH)4]-;
(3)某气体能使品红溶液褪色,但加热后又恢复,该气体为二氧化硫,二氧化硫通入Fe2(SO4)3溶液中发生反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
点评 本题考查无机物推断,涉及Fe、Al元素化合物性质,D的颜色是推断突破口,再结合转化关系推断,需要学生熟练掌握元素化合物知识,难度中等.

练习册系列答案
相关题目
16.设NA代表阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,18gH218O所含质子数为10NA | |
| B. | 1mol的-OH与1mol的OH-所含电子数均为10NA | |
| C. | 常温常压下,42g乙烯和丁烯混合气体中,极性键数为6NA | |
| D. | Na2O2的反应中,每生成0.1molO2,转移电子数目为0.4NA |
7.根据元素周期表和元素周期律分析下面的推断,其中不正确的是( )
| A. | 氢氧化镭[Ra(OH2)]比氢氧化钙的碱性强 | |
| B. | 砹(At)的单质颜色为黑色 | |
| C. | 铍(Be)的原子失电子能力比镁弱 | |
| D. | 硒(Se)化氢比硫化氢稳定 |
14.如表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
(1)请写出j原子外围电子排布式3d74s2.
(2)c、d原子半径大小c>d,第一电离能大小关系是c>d,
电负性大小关系是c<d.(以上填“>”或“<”)
(3)j元素在元素周期表中位于四周期Ⅷ族,又已知NH3•H2O的电离方程式为NH3•H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3•H2O的合理结构是b (填序号,见图).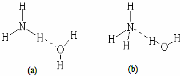
(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力 ②形成稳定结构的倾向
下表是一些主族元素的气态原子失去核外不同电子所需的能量(kJ•mol-):
表中X、Y可能分别为以上元素中的Na、Al(填写元素符号).
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为1;该元素与元素a形成的分子X的空间构型为三角锥形.
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | i | |||||||||||||
| j | |||||||||||||||||
(2)c、d原子半径大小c>d,第一电离能大小关系是c>d,
电负性大小关系是c<d.(以上填“>”或“<”)
(3)j元素在元素周期表中位于四周期Ⅷ族,又已知NH3•H2O的电离方程式为NH3•H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3•H2O的合理结构是b (填序号,见图).

(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力 ②形成稳定结构的倾向
下表是一些主族元素的气态原子失去核外不同电子所需的能量(kJ•mol-):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为1;该元素与元素a形成的分子X的空间构型为三角锥形.
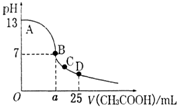 室温下,在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol•L-1 CH3COOH 溶液,pH 与滴加 CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )
室温下,在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol•L-1 CH3COOH 溶液,pH 与滴加 CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )