题目内容
13.设NA为阿伏加德罗常数的数值.下列叙述正确的是( )| A. | 1.7g的OH-中含有的电子数为NA | |
| B. | 常温常压下,1.12LO2中所含氧原子数为NA | |
| C. | 0.1molNa2O2中含O2-数为0.2NA | |
| D. | 1L1mol/LH2SO4中,含有总离子数为3NA |
分析 A.求出OH-的物质的量,然后根据OH-中含10个电子来分析;
B.常温常压Vm≠22.4L/mol;
C.过氧化钠阴离子为过氧根离子;
D.硫酸溶液中水也电离产生氢离子.
解答 解:A.1.7gOH-的物质的量为0.1mol,而OH-中含10个电子,故0.1molOH-中含1mol电子即NA个,故A正确;
B.常温常压Vm≠22.4L/mol,无法计算1.12LO2物质的量,故B错误;
C.0.1molNa2O2中含O2-数为0.1NA,故C错误;
D.硫酸溶液中水也电离产生氢离子,所以1L1mol/LH2SO4中,含有总离子数大于3NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的应用及有关计算,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,还要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,注意气体摩尔体积使用条件和对象.

练习册系列答案
相关题目
4.设 NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 标准状况下,1L 甲醇完全燃烧后生成的 CO2 分子个数约为$\frac{1}{2.42}$N A | |
| B. | N A个H2分子的质量约为2g,它所占的体积约为 22.4L | |
| C. | 标准状况下,22.4L CO2与CO的混合气体中含有的碳原子数为N A | |
| D. | 500mL 0.5mol/L 的Ca(ClO)2溶液中,含有ClO-的数目为0.5NA |
1.下列说法正确的是( )
| A. | 陶瓷、水泥、石英玻璃、光导纤维均属于硅酸盐产品 | |
| B. | 煤干馏得到的煤焦油,其主要用途是经蒸馏得到燃油,这一应用可体现“低碳生活”的理念 | |
| C. | 埃博拉病毒对化学药品敏感,乙醇、酚类、次氯酸钠溶液、双氧水均可以将病毒氧化而达到消毒的目的 | |
| D. | 扫描隧道显微技术、超分辨荧光显微技术等科技手段的发展,促进了人类对微观结构的探索,可实现对原子或分子的操控,使科学研究迈入更高水平 |
8.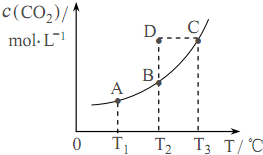 在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法正确的是( )
在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法正确的是( )
 在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法正确的是( )
在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法正确的是( )| A. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| B. | 在T2时,若反应处于状态D,则一定有V正<V逆 | |
| C. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H<0 | |
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
18.水溶液中能大量共存的一组离子是( )
| A. | Na+、Al3+、Cl-、CO32- | B. | Na+、Fe3+、Cl-、NO3- | ||
| C. | H+、Na+、ClO-、S2- | D. | K+、NH4+、OH-、SO42- |
5. 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液的颜色变化,直到因加入一滴盐酸后,溶液由红色变为无色,并半分钟内不褪色为止.
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是D(填字母序号).
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
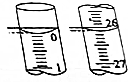
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为0.00mL,终点读数为26.10mL,所用盐酸溶液的体积为26.10mL.
(4)某学生根据3次实验分别记录有关数据如下表:
依据上表数据列式计算该NaOH溶液的物质的量浓度.
 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液的颜色变化,直到因加入一滴盐酸后,溶液由红色变为无色,并半分钟内不褪色为止.
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是D(填字母序号).
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为0.00mL,终点读数为26.10mL,所用盐酸溶液的体积为26.10mL.
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
2.25℃时,下列有关溶液中粒子的物质的量浓度关系不正确的是( )
| A. | 氨水与盐酸恰好中和后的溶液:c(H+)>c(OH-) | |
| B. | 0.2mol/L醋酸溶液与0.1mol/L NaOH溶液等体积混合后的溶液:c(CH3COO-)+c(CH3COOH)=0.2mol/L | |
| C. | NaHSO3溶液(呈酸性):c(Na+)>c(HSO3-)>c(H+)>c(OH-) | |
| D. | NaHSO4溶液滴入氨水后的溶液:c(H+)+c(NH4+)=2c(SO42-)+c(OH-). |
 过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物.请回答下列问题:
过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物.请回答下列问题: