题目内容
18.水溶液中能大量共存的一组离子是( )| A. | Na+、Al3+、Cl-、CO32- | B. | Na+、Fe3+、Cl-、NO3- | ||
| C. | H+、Na+、ClO-、S2- | D. | K+、NH4+、OH-、SO42- |
分析 根据离子之间不能结合生成沉淀、气体、水、弱电解质等,不能发生氧化还原反应等,不能相互促进水解等,则离子大量共存,以此来解答.
解答 解:A.Al3+、CO32-相互促进水解,不能大量共存,故A错误;
B.该组离子之间不反应,可大量共存,故B正确;
C.H+、ClO-、S2-发生氧化还原反应,不能大量共存,故C错误;
D.NH4+、OH-结合生成弱电解质,不能大量共存,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应、水解反应的判断,题目难度不大.

练习册系列答案
相关题目
6.如表各组物质中,满足组内甲、乙、丙任意两种物质在一定条件下均能发生反应的是( )
| 物质组别 | 甲 | 乙 | 丙 |
| A | NH3 | O2 | HNO3 |
| B | Al | HCl | NaOH |
| C | SiO2 | NaOH | HCl |
| D | CO2 | Ca(OH)2 | NaHSO3 |
| A. | A | B. | B | C. | C | D. | D |
13.设NA为阿伏加德罗常数的数值.下列叙述正确的是( )
| A. | 1.7g的OH-中含有的电子数为NA | |
| B. | 常温常压下,1.12LO2中所含氧原子数为NA | |
| C. | 0.1molNa2O2中含O2-数为0.2NA | |
| D. | 1L1mol/LH2SO4中,含有总离子数为3NA |
10.1.28g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况),将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积是( )
| A. | 504mL | B. | 168mL | C. | 336mL | D. | 224mL |
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中的信息,回答下列问题 :
溶质的物质的量浓度/ | 溶液的密度/ |
| |
硫酸 |
|
| |
氨水 |
|
|
(1)表中硫酸的质量分数为__________(不写单位,用含 、
、 的代数式表示)。
的代数式表示)。
(2)物质的量浓度为
 的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为___________
的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为___________ 。
。
(3)物质的量浓度为
 的氨水与
的氨水与

 的氨水等质量混合,所得溶液的密度______(填
的氨水等质量混合,所得溶液的密度______(填
“大于”、“小于”或“等于”,下同) 
 ,所得溶液的物质的量浓度________
,所得溶液的物质的量浓度________


(设混合后溶液的体积变化忽略不计)
(4)若将稀硫酸与氨水混合,写出其反应的离子方程式___________________________.

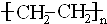 ;②C→D:CH3COOH+CH3CH2OH
;②C→D:CH3COOH+CH3CH2OH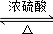 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.


 同学的实验设计方案是否严密?请说明理由:________________________________。
同学的实验设计方案是否严密?请说明理由:________________________________。