题目内容
3. 过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物.请回答下列问题:
过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物.请回答下列问题:(1)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Mn属于d区.
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.基态Ti2+中电子占据的最高能层符号为M,该能层具有的原子轨道数为9.BH4-的空间构型是正四面体型.
(3)在Cu的催化作用下,乙醇可被空气中氧气氧化为乙醛,乙醛分子中碳原子的杂化方式是sp3、sp2,乙醛分子中HCO的键角大于乙醇分子中H-C-O的键角(填“大于”、“等于”或“小于”).
(4)电镀厂排放的废水中常含有剧毒的CN-,可在TiO2的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2.
①H、C、N、O四种元素的电负性由小到大的顺序为H<C<N<O.
②与CN-互为等电子体微粒的化学式为CO(或N2等)(写出一种即可)
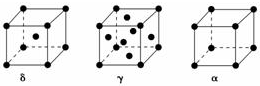
(5)单质铁有δ、γ、α三种同素异形体,三种晶胞中Fe原子的配位数之比为4:6:3,δ、γ、α三种晶胞的边长之比为$\frac{2}{\sqrt{3}}$:$\sqrt{2}$:1.
分析 (1)Mn为第ⅤⅢ族元素,最后填充电子为d电子;
(2)基态Ti2+价电子排布式为:3d2,最高能层为M层,该能层下含有1个3s轨道、3个3p轨道和5个3d轨道,共有9个原子轨道;
BH4-中B原子价层电子对=4+$\frac{1}{2}$(3+1-4×1)=4,且没有孤电子对;
(3)乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,据此判断碳原子的杂化方式,碳原子杂化方式不同导致其键角不同;
(4)①非金属性越强,电负性越大;②等电子体中原子数、价电子数相同;
(5)δ-Fe为体心立方密堆积,配位数为8,γ-Fe为面心立方密堆积,配位数为12,α=Fe为简单立方堆积,配位数为6;设Fe的原子半径为r,δ、γ、α晶胞的边长分别为a1、a2、a3,则δ中$\sqrt{3}$a1=4r,γ中$\sqrt{2}$a2=4r,α中a3=2r,以此计算.
解答 解:(1)Mn为第ⅤⅢ族元素,外围电子排布式为3d54s2,最后填充电子为d电子,则位于d区,
故答案为:d;
(2)Ti的原子序数为22,Ti2+核外有20个电子,Ti2+的电子排布式为1s22s22p63s23p63d2或[Ar]3d2,基态Ti2+价电子排布式为:3d2,最高能层为M层,该能层下含有1个3s轨道、3个3p轨道和5个3d轨道,共有9个原子轨道,BH4-中B原子价层电子对=4+$\frac{1}{2}$(3+1-4×1)=4,且没有孤电子对,则为正四面体型,
故答案为:M;9;正四面体型;
(3)乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,所以甲基中的碳原子采用sp3杂化,醛基中的碳原子采用sp2杂化,醛基中碳原子采用sp2杂化、乙醇中含有醇羟基的碳原子采用sp3杂化,导致乙醛分子中H-C-O的键角大于乙醇分子中的H-C-O的键角,
故答案为:sp3、sp2;大于;
(4)①非金属性越强,电负性越大,则电负性为H<C<N<O,
故答案为:H<C<N<O;
②与CN-互为等电子体微粒的化学式为CO(或N2等),
故答案为:CO(或N2等);
(5)δ-Fe为体心立方密堆积,配位数为8,γ-Fe为面心立方密堆积,配位数为12,α=Fe为简单立方堆积,配位数为6,则δ、γ、α三种晶胞中铁原子的配位数之比为8:12:6=4:6:3,设Fe的原子半径为r,δ、γ、α晶胞的边长分别为a1、a2、a3,则δ中$\sqrt{3}$a1=4r,γ中$\sqrt{2}$a2=4r,α中a3=2r,则边长之比为:$\frac{4}{\sqrt{3}}$r:(2$\sqrt{2}$r):(2r)=$\frac{2}{\sqrt{3}}$:$\sqrt{2}$:1,
故答案为:4:6:3;$\frac{2}{\sqrt{3}}$:$\sqrt{2}$:1.
点评 本题考查晶胞计算、分子空间构型、电负性等,为高频考点,把握物质的结构与性质的关系等为解答的关键,侧重分析与应用能力的考查,注意(5)为解答的难点,题目难度中等.

 名校课堂系列答案
名校课堂系列答案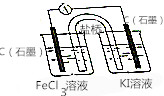 按如图所示装置(盐桥内含有KCl饱和溶液)线路连接后,可发现电流表指针明显偏转,说明发生了原电池反应,下列关于该电池的叙述正确的是( )
按如图所示装置(盐桥内含有KCl饱和溶液)线路连接后,可发现电流表指针明显偏转,说明发生了原电池反应,下列关于该电池的叙述正确的是( )| A. | 左侧石墨为电池的正极,电极反应:Fe3++e-═Fe2+ | |
| B. | 右侧烧杯中发生还原反应,电极反应:2I--2e-═I2 | |
| C. | 右侧烧杯内溶液颜色变浅 | |
| D. | 盐桥中的K+流向右侧烧杯 |
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 | |
| B. | 乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 | |
| C. | 丙中含有第2周期ⅣA 族的元素,则丙可能是甲烷的卤代物 | |
| D. | 丁和甲中各元素质量比相同,则丁可能是C2H2 |
| A. | 钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 金属铝溶于氢氧化钠溶液中:Al+2OH-═Al${O}_{2}^{-}$+H2↑ | |
| C. | 金属铝溶于盐酸中:2Al+6H+═2Al3++3H2↑ | |
| D. | Fe(OH)3跟盐酸反应:OH-+H+═H2O |
| A. | CO2的摩尔质量为44g | |
| B. | 1 mol N2的质量是14g | |
| C. | 标准状况下,1 mol CO2所占的体积约是22.4L | |
| D. | 将40 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol/L |
| A. | 1.7g的OH-中含有的电子数为NA | |
| B. | 常温常压下,1.12LO2中所含氧原子数为NA | |
| C. | 0.1molNa2O2中含O2-数为0.2NA | |
| D. | 1L1mol/LH2SO4中,含有总离子数为3NA |
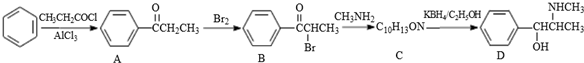
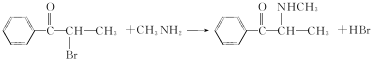 .C-D的反应类型为还原反应.
.C-D的反应类型为还原反应.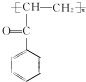 .
.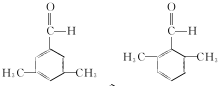 (写结构简式).
(写结构简式).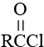 .参照上述合成路线,设计一条由苯和乙酸为起始原料制备
.参照上述合成路线,设计一条由苯和乙酸为起始原料制备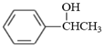 的合成路线:
的合成路线: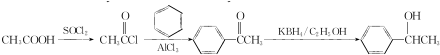 .
.
 ;②C→D:CH3COOH+CH3CH2OH
;②C→D:CH3COOH+CH3CH2OH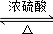 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.