题目内容
(1)天然气是一种清洁高效的能源,其主要成分为甲烷.CH4的摩尔质量为 ,4.8gCH4的物质的量为 ,在标准状况下的体积约为 ,所含氢原子数为 .
(2)某化学兴趣小组对某矿泉水进行检测,发现0.5L该矿泉水中含有10.8mgMg2+,则Mg2+的物质的量浓度为 .
(3)体积比为1:2:3的氯化钠、氯化镁和氯化铝溶液,分别加入等体积、等浓度的硝酸银溶液,均恰好完全反应生成氯化银沉淀,则这三种溶液的物质的量浓度之比为 .
(2)某化学兴趣小组对某矿泉水进行检测,发现0.5L该矿泉水中含有10.8mgMg2+,则Mg2+的物质的量浓度为
(3)体积比为1:2:3的氯化钠、氯化镁和氯化铝溶液,分别加入等体积、等浓度的硝酸银溶液,均恰好完全反应生成氯化银沉淀,则这三种溶液的物质的量浓度之比为
考点:物质分子中的原子个数计算,离子方程式的有关计算,物质的量浓度的相关计算
专题:计算题
分析:解:(1)根据甲烷的相对分子量完成甲烷的摩尔质量;根据n=
计算出甲烷的物质的量,然后再根据计算出甲烷的标况下的体积、含有氢原子的数目;
(2)根据n=
计算出镁离子的物质的量,再根据c=
计算出镁离子的物质的量浓度;
(3)反应消耗的硝酸银的体积、浓度相同,说明三种物质提供的氯离子的物质的量相等,根据其化学式组成及体积之比计算出这三种溶液的物质的量浓度之比.
| m |
| M |
(2)根据n=
| m |
| M |
| n |
| V |
(3)反应消耗的硝酸银的体积、浓度相同,说明三种物质提供的氯离子的物质的量相等,根据其化学式组成及体积之比计算出这三种溶液的物质的量浓度之比.
解答:
解:(1)甲烷的相对分子量为16,所以甲烷的摩尔质量为16g/mol;4.8g甲烷的物质的量为:n=
=0.3mol;标准状况下0.3mol甲烷的体积为:V=22.4L/mol×0.3mol=6.72L;0.3mol甲烷中含有1.2mol氢原子,含有氢原子的数目为:6.03×1023×1.2=7.224×1023,
故答案为:16g/mol;0.3mol;6.72L;7.224×1023 (1.2NA);
(2)10.8mg Mg2+的物质的量为:n=
=4.5×10-4mol,镁离子的物质的量浓度为:c(Mg2+)=
mol=9×10-4mol/L,
故答案为:9×10-4mol/L;
(3)体积比为1:2:3的氯化钠、氯化镁和氯化铝溶液,设体积分别为V、2V、和3V;分别加入等体积、等浓度的硝酸银溶液,均恰好完全反应生成氯化银沉淀,说明三种溶液中含有的氯离子的物质的量相等,设硝酸银的物质的量为n,则氯化钠的物质的量为n,氯化镁的物质的量为0.5n,氯化铝的物质的量为
,这三种溶液的物质的量浓度之比为:
:
:
=36:9:4,
故答案为:36:9:4.
| 4.8g |
| 16g/mol |
故答案为:16g/mol;0.3mol;6.72L;7.224×1023 (1.2NA);
(2)10.8mg Mg2+的物质的量为:n=
| 10.8×10-3g |
| 24g/mol |
| 4.5×10-4mol |
| 0.5L |
故答案为:9×10-4mol/L;
(3)体积比为1:2:3的氯化钠、氯化镁和氯化铝溶液,设体积分别为V、2V、和3V;分别加入等体积、等浓度的硝酸银溶液,均恰好完全反应生成氯化银沉淀,说明三种溶液中含有的氯离子的物质的量相等,设硝酸银的物质的量为n,则氯化钠的物质的量为n,氯化镁的物质的量为0.5n,氯化铝的物质的量为
| n |
| 3 |
| n |
| V |
| ||
| 2V |
| ||
| 3V |
故答案为:36:9:4.
点评:本题考查了物质的量浓度的计算、物质分子中原子个数的计算,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量、标况下的气体摩尔体积等物理量之间的转化关系,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
构成SiO2的化学键在性质上和构成CO2分子的共价键都是极性键,所以( )
| A、SiO2和CO2都属于原子晶体 |
| B、SiO2和CO2都是分子晶体 |
| C、前者是原子晶体,后者是分子晶体 |
| D、前者是分子晶体,后者是原子晶体 |
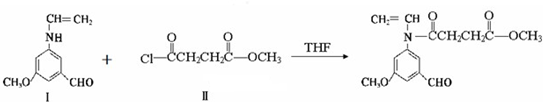
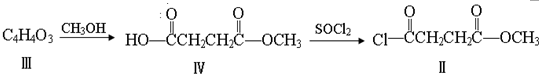
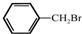 与
与 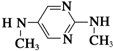 在一定条件下按物质的量2:1的比例发生类似
在一定条件下按物质的量2:1的比例发生类似
 系统命名为
系统命名为 的炔烃的结构简式
的炔烃的结构简式 系统命名为
系统命名为