题目内容
15.卤族元素包括F、Cl、Br、I等.(1)基态Br原子的核外电子排布式为[Ar]3d104s23p5,其价电子层成对与未成对电子个数比为6:1
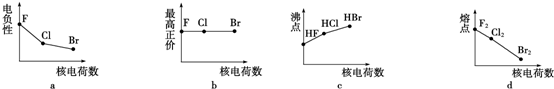
(2)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是a
(3)BCl3中心原子的杂化方式为sp2,NCl3分子的空间构型为三角锥形;第一电离能介于B、N
之间的第二周期元素有Be、C、O(填元素符号).
分析 (1)溴是35号元素,根据构造原理写出核外电子排布式,主族元素的价电子是最外层电子;
(2)a.卤族元素元素非金属性越强其电负性越大;
b.F元素没有正化合价;
c.卤族元素氢化物沸点随着原子序数增大而增大,但含有氢键的卤化氢沸点最高;
d.卤族元素单质的熔点随着原子序数增大而增大;
(3)根据价层电子对互斥理论确定原子杂化方式,同一周期元素中,元素第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素.
解答 解:(1)溴是35号元素,核外电子排布式为[Ar]3d104s23p5,主族元素的价电子是最外层电子,有7个,有6个成对,1个未成对,所以价电子层成对与未成对电子个数比为6:1,故答案为:[Ar]3d104s23p5;6:1.
(2)a.卤族元素元素非金属性越强其电负性越大,卤族元素非金属性随着原子序数增大而增大,所以电负性随着原子序数增大而增大,故正确;
b.F元素没有正化合价,其它卤族元素最高正价为+7价,故错误;
c.卤族元素氢化物沸点随着原子序数增大而增大,但含有氢键的卤化氢沸点最高,HF中存在氢键,所以沸点最高,故错误;
d.卤族元素单质的熔点随着原子序数增大而增大,故错误;
故答案为:a;
(3)BCl3分子中B原子价层电子对个数=3+$\frac{3-3×1}{2}$=3且不含孤电子对,所以B原子采用sp2杂化;NCl3中中心原子价层电子对个数3+$\frac{5-3×1}{2}$=4且含有一个孤电子对,所以分子构型为三角锥形;同一周期元素中,元素第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,所以第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素;
故答案为:sp2;三角锥形;Be、C、O.
点评 本题考查核外电子排布、卤素的性质、杂化理论、第一电离能等知识,为高频考点,侧重分析与应用能力的考查,注意第一电离能的变化规律及异常现象,题目难度中等.

 阅读快车系列答案
阅读快车系列答案C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol
与这些碳完全燃烧相比,损失的热量是( )
| A. | 1132 kJ | B. | 283kJ | C. | 442 kJ | D. | 990.5kJ |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | |||
| 4 | ② |
(填元素符号或化学式,下同.)
(2)这些元素形成的最高价氧化物对应的水化物中碱性最强的KOH,酸性最强的HClO4;
(3)①、②、③、④、⑤这五种元素的原子半径由大到小的顺序为K>Na>Mg>Al>C;
(4)⑥的氢化物的电子式为
 ,
,①在空气中燃烧后生成产物的电子式
 .
. | A. | Fe2+ K+NO3-Cl- | B. | Na+Mg2+ HCO3- NO3- | ||
| C. | K+ Na+ AlO2-Cl- | D. | Al3+ NH4+ SO42-Cl- |
| A. | 生石灰-Ca(OH)2 | B. | 小苏打-KHCO3 | C. | 重晶石-CaSO4 | D. | 醋酸-C2H4O2 |

 ,A的晶体类型离子晶体.
,A的晶体类型离子晶体.

 $\stackrel{NaOH溶液,△}{→}$CH3COONa+
$\stackrel{NaOH溶液,△}{→}$CH3COONa+ -ONa)
-ONa)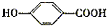 .
. 或
或 .
. ,反应类型是消去反应.
,反应类型是消去反应.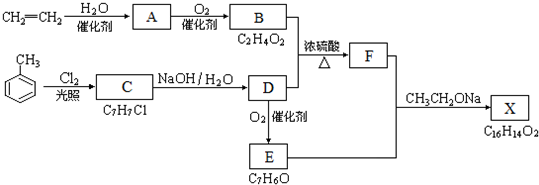
 ;
; ;
;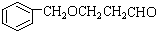 B、
B、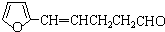
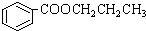
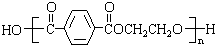 ,其合成单体为
,其合成单体为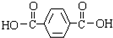 和HOCH2CH2OH;
和HOCH2CH2OH;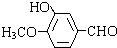 )的重要原料,写出同时满足下列条件的M的同分异构体的结构简式:
)的重要原料,写出同时满足下列条件的M的同分异构体的结构简式: .
.