题目内容
11.下列物质中所含的分子数相等的是( )①0.1mol CO2
②9.8g H2SO4
③180g H2O
④标准状况下22.4L H2.
| A. | ②③ | B. | ①② | C. | ①④ | D. | ③④ |
分析 根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$解答该题.
解答 解:①0.1mol CO2;
②9.8g H2SO4的物质的量为$\frac{9.8g}{98g/mol}$=0.1mol;
③180g H2O的物质的量为$\frac{180g}{18g/mol}$=10mol;
④标准状况下22.4L H2的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,
由N=nNA可知,物质的量相等,则分子数相等,则相等的为①②,
故选B.
点评 本题考查物质的量的计算,题目难度不大,注意相关计算公式的运用,根据相关计算公式判断各物理量之间的关系.

练习册系列答案
相关题目
7.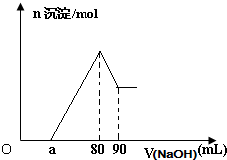 将一块镁铝合金投入一定体积的1mol/L稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图.下列说法中不正确的是( )
将一块镁铝合金投入一定体积的1mol/L稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图.下列说法中不正确的是( )
 将一块镁铝合金投入一定体积的1mol/L稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图.下列说法中不正确的是( )
将一块镁铝合金投入一定体积的1mol/L稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图.下列说法中不正确的是( )| A. | 由图可以确定该镁铝合金中铝的质量为0.27 g | |
| B. | 由图可以确定该合金中两元素的物质量之比的最大值为4 | |
| C. | 当滴入1mol/L的NaOH溶液85mL时,所得沉淀的成分为Mg(OH)2和Al(OH)3 | |
| D. | 由图可以确定a的取值范围为:0≤a≤50 |
2.下列离子方程式正确的是( )
| A. | 钠与水反应 Na+H2O═Na++OH-+H2↑ | |
| B. | 碳酸钠与稀硫酸反应CO32-+2H+═CO2↑+H2O | |
| C. | 氢氧化铜与稀硫酸反应OH-+H+═H2O | |
| D. | 铁与盐酸反应2Fe+6H+═2Fe3++3H2↑ |
19.只用水不能鉴别的一组物质是( )
| A. | 乙醇和乙酸 | B. | 乙酸乙酯和乙醇 | C. | 苯和四氯化碳 | D. | 苯和乙酸 |
6.48克碳在3.5mol氧气中不完全燃烧,待反应物耗尽,且
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol
与这些碳完全燃烧相比,损失的热量是( )
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol
与这些碳完全燃烧相比,损失的热量是( )
| A. | 1132 kJ | B. | 283kJ | C. | 442 kJ | D. | 990.5kJ |
16.“天宫一号”使用镍氢电池供电.镍氢电池的负极材料为储氢合金(用-表示,氢以单原子填入合金晶格),总反应为M+Ni(OH)2$?_{放电}^{充电}$MH+NiOOH,下列说法正确的是( )
| A. | 电池充电时氢原子被氧化 | |
| B. | 电池放电时正极为NiOOH | |
| C. | 电池充电时,与电源负极相连的电极反应为:MH+OH--e-═M+H2O | |
| D. | 电池放电时,负极反应为:Ni(OH)2+OH--e-=NiOOH+H2O |
1.下列关于物质“反应程度”的说法正确的是( )
| A. | 一定条件下,2mol SO2与足量O2反应可得到2mol SO3 | |
| B. | 含4mol HCl 的浓盐酸与足量的MnO2加热反应可制备1mol Cl2 | |
| C. | 10ml 18.0 mol/L H2SO4与足量铜加热反应可制备0.09 mol SO2 | |
| D. | 一定条件下,1mol N2与3 mol H2反应可制备1.0 mol NH3 |
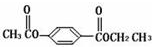
 $\stackrel{NaOH溶液,△}{→}$CH3COONa+
$\stackrel{NaOH溶液,△}{→}$CH3COONa+ -ONa)
-ONa)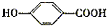 .
. 或
或 .
. ,反应类型是消去反应.
,反应类型是消去反应.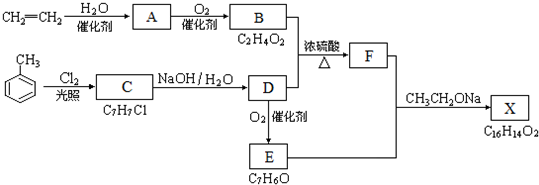
 ;
; ;
;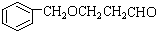 B、
B、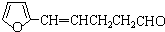
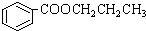
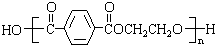 ,其合成单体为
,其合成单体为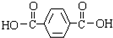 和HOCH2CH2OH;
和HOCH2CH2OH;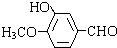 )的重要原料,写出同时满足下列条件的M的同分异构体的结构简式:
)的重要原料,写出同时满足下列条件的M的同分异构体的结构简式: .
.