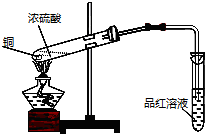
题目内容
18.下列有关说法正确的是( )| A. | 将pH=10的浓氨水稀释,溶液中所有离子的浓度都减小 | |
| B. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合液中,c(H+)<c(OH-) |
分析 A.稀释过程中企业广告离子浓度减小,而水的离子积不变,则氢离子浓度增大;
B.反应自发进行的判断依据是△H-T△S<0;
C.该反应为放热反应,升高温度后平衡向着逆向移动,则氢气的转化率降低;
D.氨水为弱碱,混合液中氨水过量,溶液呈碱性.
解答 解:A.将pH=10的浓氨水稀释,溶液中氢氧根离子、铵根离子的浓度减小,由于水的离子积不变,则氢离子的浓度会增大,故A错误;
B.CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,反应△S>0,△H-T△S>0,说明该反应的△H>0,故B错误;
C.N2(g)+3H2(g)?2NH3(g)的△H<0,说明为放热反应,升高温度后反应速率增大,但平衡向着逆向移动,导致氢气的转化率减小,故C错误;
D.pH=3的盐酸和pH=11的氨水等体积混合液中,由于氨水为弱碱,则混合液中氨水过量,反应后溶液呈碱性,则c(H+)<c(OH-),故D正确;
故选D.
点评 本题考查了反应热与焓变的应用、酸碱混合的定性判断,题目难度中等,明确判断反应自发进行的方法为解答关键,注意掌握化学平衡及其影响因素,D为易错点,注意弱电解质在溶液中部分电离的特点.

练习册系列答案
相关题目
14.下列说法不正确的是( )
| A. | 苯甲酸共有四个同分异构体(含苯环且包括苯甲酸) | |
| B. | 相同条件下的沸点:乙二醇>乙醇>乙烷>甲烷 | |
| C. | CH3COOCH3在核磁共振氢谱中有两种不同类型的氢原子 | |
| D. | 两种不同的氨基酸在缩聚反应时可生成不少于4种的聚合物 |
9.下列离子在溶液中因氧化还原反应而不能大量共存的是( )
| A. | Na+Ba2+ SO42- OH- | B. | Ag+ NO3? Cl?K+ | ||
| C. | H+ NO3-Fe2+ K+ | D. | Cu2+NH4+OH- SO42- |
6.48克碳在3.5mol氧气中不完全燃烧,待反应物耗尽,且
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol
与这些碳完全燃烧相比,损失的热量是( )
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol
与这些碳完全燃烧相比,损失的热量是( )
| A. | 1132 kJ | B. | 283kJ | C. | 442 kJ | D. | 990.5kJ |
13.玻璃棒是化学实验中最常用的一种仪器.下列实验中要用到玻璃棒的是( )
| A. | 用pH试纸测定水样的pH | B. | 检验硫酸根离子 | ||
| C. | 实验室用高锰酸钾制取氧气 | D. | 从碘水中萃取碘 |
10.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.请用相关的化学术语回答下列问题:
(1)在这些元素中,最不活泼的是Ar,非金属性最强的是O,金属性最强的是K;
(填元素符号或化学式,下同.)
(2)这些元素形成的最高价氧化物对应的水化物中碱性最强的KOH,酸性最强的HClO4;
(3)①、②、③、④、⑤这五种元素的原子半径由大到小的顺序为K>Na>Mg>Al>C;
(4)⑥的氢化物的电子式为 ,
,
①在空气中燃烧后生成产物的电子式 .
.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | |||
| 4 | ② |
(填元素符号或化学式,下同.)
(2)这些元素形成的最高价氧化物对应的水化物中碱性最强的KOH,酸性最强的HClO4;
(3)①、②、③、④、⑤这五种元素的原子半径由大到小的顺序为K>Na>Mg>Al>C;
(4)⑥的氢化物的电子式为
 ,
,①在空气中燃烧后生成产物的电子式
 .
. 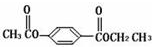
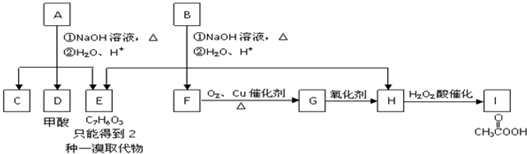
 $\stackrel{NaOH溶液,△}{→}$CH3COONa+
$\stackrel{NaOH溶液,△}{→}$CH3COONa+ -ONa)
-ONa)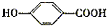 .
. 或
或 .
. ,反应类型是消去反应.
,反应类型是消去反应.