题目内容
12.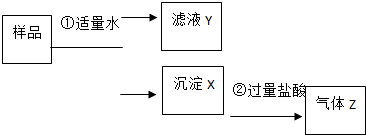 某固体物质是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2 中的几种均匀混合而成,取样品进行如下实验(部分产物略去):
某固体物质是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2 中的几种均匀混合而成,取样品进行如下实验(部分产物略去):(1)Z化学式是CO2.
(2)在实验②中观察到的现象是“沉淀部分溶解”.为进一步确定X的组成,向实验②后的溶液中滴加过量的氨水,有沉淀生成,写出生成沉淀的离子反应方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,则沉淀X含有的物质的化学式为CaCO3、BaSO4、Al(OH)3.
(3)取滤液Y,测得其pH>7,向其中滴入硫酸钠溶液,未观察到任何现象,则滤液Y中一定含有的含氧酸根离子是(用离子符号表示)AlO2-、NO3-,由此推测“将过量的气体Z通入滤液Y中”的实验现象是有白色沉淀生成并不溶解.
(4)上述推断可见,实验①中能反应的物质之间的物质的量的比例关系为(用$\frac{n(A)}{n(B)}$形式表示)$\frac{1}{4}$<$\frac{n(AlC{l}_{3})}{n(NaOH)}$<$\frac{1}{3}$、$\frac{n[Ba(N{O}_{3})_{2}]}{n({K}_{2}S{O}_{4})}$<1.
分析 样品溶于水得到沉淀和滤液,沉淀X可能是CaCO3或K2SO4和Ba(NO3)2混合生成的硫酸钡沉淀;或NaOH和AlCl3的混合物生成的沉淀Al(OH)3;沉淀加入过量盐酸生成气体Z,证明溶于水形成的沉淀一定含有CaCO3,以此来解答.
解答 解:样品溶于水得到沉淀和滤液,沉淀X可能是CaCO3或K2SO4和Ba(NO3)2混合生成的硫酸钡沉淀;或NaOH和AlCl3的混合物生成的沉淀Al(OH)3;沉淀加入过量盐酸生成气体Z,证明溶于水形成的沉淀一定含有CaCO3,
(1)碳酸钙与盐酸反应生成Z为CO2,故答案为:CO2;
(2)沉淀部分溶解说明有硫酸钡,向实验②后的溶液中滴加过量的氨水,有沉淀生成,说明原来有AlCl3,即X中有Al(OH)3,则氨水与铝离子的反应方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,所以X中含有CaCO3、BaSO4、Al(OH)3;
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;CaCO3;BaSO4;Al(OH)3;
(3)取滤液Y,测得其pH>7,说明滤液Y中含有的含氧根离子可能是AlO2-、NO3-;根据(2)判断X中含有CaCO3、BaSO4、Al(OH)3;
加过量盐酸产生气体Z,则Z为二氧化碳,因为氢氧化铝只与强酸强碱反应,所以将过量的气体Z通入滤液Y中,二氧化碳与AlO2-反应只生成氢氧化铝沉淀,
故答案为:AlO2-、NO3-;有白色沉淀生成并不溶解;
(4)取滤液Y,分析可知其中含有AlO2-;根据Al3++3OH-=Al(OH)3↓,Al3++4OH-=AlO2-+2H2O,所以$\frac{1}{4}$<$\frac{n(AlC{l}_{3})}{n(NaOH)}$<$\frac{1}{3}$;向其中滴入硫酸钠溶液,未观察到任何现象,说明钡离子完全反应,即硫酸钾过量,所以$\frac{n[Ba(N{O}_{3})_{2}]}{n({K}_{2}S{O}_{4})}$<1,
故答案为:$\frac{1}{4}$<$\frac{n(AlC{l}_{3})}{n(NaOH)}$<$\frac{1}{3}$;$\frac{n[Ba(N{O}_{3})_{2}]}{n({K}_{2}S{O}_{4})}$<1.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与应用能力的考查,注意沉淀X成分的判断,题目难度不大.

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案| A. | KNO3 | B. | CO2 | C. | Fe | D. | C2H5OH |
| A. | AgCl的溶解度增大 | B. | AgCl的溶解度增大,Ksp不变 | ||
| C. | C(Ag+)增大 | D. | AgCl的溶解度、Ksp均不变 |
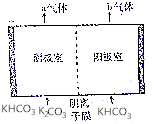 为实现CO2减排,目前较成熟的方法是用碳酸钾溶液为吸收剂捕集工业烟气中的CO2.利用电解法可实现吸收后的溶液(称为富液)的再生.将富液通人阴极室,将KHCO3溶液加入阳极室进行电解,其原理如图所示.下列有关描述不正确的是( )
为实现CO2减排,目前较成熟的方法是用碳酸钾溶液为吸收剂捕集工业烟气中的CO2.利用电解法可实现吸收后的溶液(称为富液)的再生.将富液通人阴极室,将KHCO3溶液加入阳极室进行电解,其原理如图所示.下列有关描述不正确的是( )| A. | 阴极室产生的a气体是H2 | B. | 阳极室产生的b气体是CO2 | ||
| C. | 阴离子从阴极室向阳极室迁移 | D. | 再生液(K2CO3)在阴极室产生 |
| A. | Na2SO3溶液(HCl酸化的BaCl2溶液) | B. | 氯水(AgNO3溶液) | ||
| C. | 漂白粉(稀硝酸) | D. | NaOH溶液(Ba(OH)2溶液) |
| A. | 使用催化剂能加快化学反应速率 | |
| B. | 增大O2浓度可以使SO2转化率达到100% | |
| C. | 降低反应温度,化学反应速率减慢 | |
| D. | 增大O2浓度,化学反应速率增大 |

| A. | 正反应为吸热反应,D是固体 | B. | 正反应为吸热反应,D是气体 | ||
| C. | 正反应为放热反应,D是固体或液体 | D. | 正反应为放热反应,D是气体 |
 A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大,A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,C与B同主族,D元素的价电子数是其余电子数的一半,E与D同族,F与A同主族,回答下列问题:
A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大,A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,C与B同主族,D元素的价电子数是其余电子数的一半,E与D同族,F与A同主族,回答下列问题: 某同学通过查阅资料得知,铝热反应所得到的熔融物应该是铁铝合金.
某同学通过查阅资料得知,铝热反应所得到的熔融物应该是铁铝合金.