题目内容
7.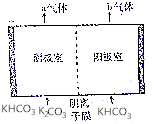 为实现CO2减排,目前较成熟的方法是用碳酸钾溶液为吸收剂捕集工业烟气中的CO2.利用电解法可实现吸收后的溶液(称为富液)的再生.将富液通人阴极室,将KHCO3溶液加入阳极室进行电解,其原理如图所示.下列有关描述不正确的是( )
为实现CO2减排,目前较成熟的方法是用碳酸钾溶液为吸收剂捕集工业烟气中的CO2.利用电解法可实现吸收后的溶液(称为富液)的再生.将富液通人阴极室,将KHCO3溶液加入阳极室进行电解,其原理如图所示.下列有关描述不正确的是( )| A. | 阴极室产生的a气体是H2 | B. | 阳极室产生的b气体是CO2 | ||
| C. | 阴离子从阴极室向阳极室迁移 | D. | 再生液(K2CO3)在阴极室产生 |
分析 阴极发生还原反应,2H2O+2e-═H2↑+2OH-,OH-与HCO3-反应得到CO32-,再生碳酸钾溶液,阳极发生氧化反应,OH-在阳极失电子:2H2O-4e-═O2↑+4H+,产生的H+消耗溶液中的HCO3-:H++HCO3-═CO2↑+H2O,在阴极室中的HCO3-、CO32-进入阳极室,发生反应CO32-+CO2+H2O═2HCO3-或CO32-+H+═HCO3-,使HCO3-得以补充,使阳极溶液组成和浓度基本不变.
解答 解:阴极发生还原反应,2H2O+2e-═H2↑+2OH-,OH-与HCO3-反应得到CO32-,阴极室产生的a气体是H2,再生液(K2CO3)在阴极室产生;
阳极发生氧化反应,OH-在阳极失电子:2H2O-4e-═O2↑+4H+,产生的H+消耗溶液中的HCO3-:H++HCO3-═CO2↑+H2O,在阴极室中的HCO3-、CO32-进入阳极室,发生反应CO32-+CO2+H2O═2HCO3-或CO32-+H+═HCO3-,使HCO3-得以补充,使阳极溶液组成和浓度基本不变,阳极室产生的b气体是O2、CO2,
故选:B.
点评 本题考查电解原理应用,侧重考查学生运用知识分析解决问题的能力,难度中等.

练习册系列答案
相关题目
15.有a mL三种气态烃的混合物与足量的氧气混合点燃爆炸后,恢复到原来的状态(常温、常压),体积共缩小2a mL.则三种烃不可能是( )
| A. | CH4、C2H4、C3H4 | B. | C2H4、C3H8、C2H6 | C. | C2H2、C2H4、C3H6 | D. | C2H2、C2H6、C3H8 |
2.下列有关说法不正确的是( )
| A. | 石油裂解、海水制镁、纤维素制火棉都包含化学变化 | |
| B. | 蛋白质、棉花、聚氯乙烯、淀粉都是自然界存在的天然高分子化合物 | |
| C. | 2013年诺贝尔化学奖授予三位美国化学家,以表彰他们设计出多尺度复杂化学系统模型,将传统化学实验搬到了网络世界,这一完美结合现实与理论的化学系统模型,为全面了解并预测化学反应进程奠定了基础 | |
| D. | 一些有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低极易被引燃,加热时最好用水浴加热 |
19.A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
请回答下列问题:
(1)C、D、E三种原子对应的离子半径由大到小的顺序是S2->O2->Na+(填离子符号)
(2)A、B、C、D的任意三种元素可组成多种化合物,X和Y是其中的两种;X和Y都是既含离子键又含有共价键的离子化合物:将X、Y分别溶于水时,X能促进水的电离,而Y能抑制水的电离,X水溶液的PH<7,Y水溶液PH>7.将0.2mol/L的X溶液与0.1mol/L的Y溶液等体积混合后,溶液呈碱性.请判断:
①X的化学式为NH4NO3,Y的化学式为NaOH
②混合溶液中各种带电微粒的物质的量的浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(Na+ )>c(OH-)>c(H+)
(3)A、C两元素的单质与熔融K2CO3组成的燃料电池,其负极反应式为H2+CO32--2e-=CO2↑+H2O用该电池电解1L 1mol/L NaCl溶液,当消耗标准状况下1.12L A2时,NaCl溶液的PH=13(假设电解过程中溶液的体积不变).
(4)25℃,两种酸的电离平衡常数如下表:
请写出H2SO3溶液和NaHCO3溶液反应的主要离子方程式H2SO3+HCO3-=HSO3-+H2O+CO2↑
(5)常温下0.2mol/L的H2C2O4溶液的PH为2.1.H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫红色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O又知该反应开始时速率较慢,随后大大加快,可能的原因是反应生成Mn2+对反应起到催化作用(忽略反应的热效应)
请回答下列问题:
(1)C、D、E三种原子对应的离子半径由大到小的顺序是S2->O2->Na+(填离子符号)
(2)A、B、C、D的任意三种元素可组成多种化合物,X和Y是其中的两种;X和Y都是既含离子键又含有共价键的离子化合物:将X、Y分别溶于水时,X能促进水的电离,而Y能抑制水的电离,X水溶液的PH<7,Y水溶液PH>7.将0.2mol/L的X溶液与0.1mol/L的Y溶液等体积混合后,溶液呈碱性.请判断:
①X的化学式为NH4NO3,Y的化学式为NaOH
②混合溶液中各种带电微粒的物质的量的浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(Na+ )>c(OH-)>c(H+)
(3)A、C两元素的单质与熔融K2CO3组成的燃料电池,其负极反应式为H2+CO32--2e-=CO2↑+H2O用该电池电解1L 1mol/L NaCl溶液,当消耗标准状况下1.12L A2时,NaCl溶液的PH=13(假设电解过程中溶液的体积不变).
(4)25℃,两种酸的电离平衡常数如下表:
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
(5)常温下0.2mol/L的H2C2O4溶液的PH为2.1.H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫红色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O又知该反应开始时速率较慢,随后大大加快,可能的原因是反应生成Mn2+对反应起到催化作用(忽略反应的热效应)
16.一定温度下,在2.5L的恒容密闭容器中发生如下反应:CO2(g)+H2S(g)?COS(g)+H2O(g)
下列说法不正确的是( )
| 实验 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
| CO2 | H2S | H2O | |||
| Ⅰ | 607 | 0.11 | 0.41 | 0.01 | |
| Ⅱ | 607 | 0.22 | 0.82 | ||
| Ⅲ | 620 | 0.1 | 0.4 | 6.74×10-3 | |
| A. | 该反应正反应为吸热反应 | |
| B. | 607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行 | |
| C. | 实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol | |
| D. | 实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变 |
17.下列物质中最简式相同,但既不是同系物,也不是同分异构体的是( )
| A. | CH3CH═CH2和 | B. | 乙炔和苯 | C. |  和 和 | D. | 苯和苯酚 |
 .
.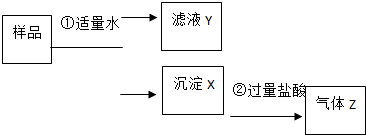 某固体物质是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2 中的几种均匀混合而成,取样品进行如下实验(部分产物略去):
某固体物质是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2 中的几种均匀混合而成,取样品进行如下实验(部分产物略去):