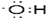题目内容
10.实验室欲用NaOH固体配制1.0mol/L的NaOH溶液240mL.一般可以分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤移液 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
(1)配制溶液时,其正确的操作顺序为②①③⑧⑤⑨⑥⑦④(填序号).本实验必须用到的仪器有托盘天平、药匙、玻璃棒、烧杯、250mL容量瓶、胶头滴管.
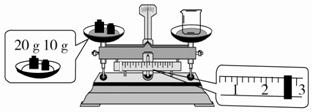
(2)某同学欲称量NaOH的质量,先用托盘天平称量烧杯的质量,托盘天平平衡后的状态如图所示.烧杯的实际质量为27.4g,要完成本实验该同学应称量10.0g NaOH.
(3)使用容量瓶前必须进行的一步操作是检查是否漏水.
(4)配制过程中,下列操作会引起所配溶液浓度偏高的是BC(填序号).
A.转移溶液时,有少量溶液洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却至室温就将溶液移入容量瓶中并定容
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加蒸馏水至刻度线.
分析 (1)配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,据此排序选择合适的仪器;
(2)天平称量的问题,先看图中称量方式是否是左物右码,如果不是,质量为砝码减游码,再据图读数;依据m=CVM计算需要溶质的质量;
(3)容量瓶带有活塞,使用时需要上下颠倒摇匀,为防止漏液,使用前应检查是否漏水;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,所以正确的操作步骤为:②①③⑧⑤⑨⑥⑦④;需要的仪器:托盘天平、药匙、玻璃棒、烧杯、容量瓶、胶头滴管,配制250mL溶液应选择250mL容量瓶,所以还需要的仪器:250mL容量瓶、胶头滴管;
故答案为:②①③⑧⑤⑨⑥⑦④;250mL容量瓶;胶头滴管;
(2)先看图中称量方式是左码右物,所称物品质量为砝码-游码,再据图读数,砝码20、10共30g,游码2.6g,所以烧杯质量为10+20-2.6=27.4g;配制1.0mol/L的NaOH溶液240mL,应选择250mL容量瓶,实际配制250mL溶液,需要溶质的质量为:1.0mol/L×0.25L×40g/mol=10.0g;
故答案为:27.4;10.0;
(3)容量瓶带有活塞,使用时需要上下颠倒摇匀,为防止漏液,使用前应检查是否漏水;
故答案为:检查是否漏水;
(4)A.转移溶液时,有少量溶液洒到容量瓶外面,导致溶质的物质的量偏小,溶液浓度偏低,故A不选;
B.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故B选;
C.未冷却至室温就将溶液移入容量瓶中并定容,冷却后溶液体积偏小,溶液浓度偏高,故C选;
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低,故D不选;
故选:BC.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶使用方法、托盘天平的使用方法及注意事项,题目难度不大.

| A. | $\frac{1}{2}$N2H4+$\frac{1}{2}$O2═$\frac{1}{2}$N2+H2O△H=-267 kJ•mol-1 | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-133.5 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534 kJ | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534 kJ•mol-1 |
| A. | 4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ | |
| B. | 平衡时v正(O2)=v逆(NO) | |
| C. | 平衡后降低压强,混合气体平均摩尔质量增大 | |
| D. | 平衡后升高温度,混合气体中NO含量降低 |
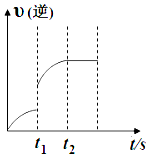 已知反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,某温度下,向5L密闭容器中加入2mol C(s)与1mol H2O(g),t1s时,CO的物质的量为0.20mol,到第t2s时恰好达到平衡,此时CO的物质的量为0.35mol,下列说法正确的是( )
已知反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,某温度下,向5L密闭容器中加入2mol C(s)与1mol H2O(g),t1s时,CO的物质的量为0.20mol,到第t2s时恰好达到平衡,此时CO的物质的量为0.35mol,下列说法正确的是( )| A. | t1时改变的条件可能是使用催化剂 | |
| B. | t1时改变的条件可能是增大 H2O 浓度 | |
| C. | t1~t2这段时间内的化学反应速率 v(H2O)=$\frac{{t}_{2}-{t}_{1}}{0.15}$ | |
| D. | t2后继续加入 2 mol C(s)平衡向正反应方向移动 |
| A. | Na与水反应时增大水的用量 | |
| B. | Fe与稀硫酸反应制取H2时,改用浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大反应容器体积 | |
| D. | Al在氧气中燃烧生成Al2O3,将Al片改成Al粉 |
| A. | KMnO4=K++Mn7++4O2- | B. | Ba(OH)2═Ba2++(OH-)2 | ||
| C. | Mg(NO3)2=Mg+2+2NO3- | D. | NaHCO3═Na++HCO3- |
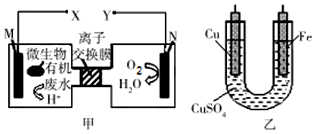
| A. | M电极反应式:(C6H10O5)n+7nH2O-24ne-═6nCO2↑+24nH+ | |
| B. | 铜电极应与X相连接 | |
| C. | 质子透过离子交换膜由右向左移动 | |
| D. | 当N电极消耗0.2 mol气体时,则铁电极增重16g |
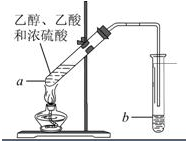 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.