题目内容
 铁在地壳中的含量约占 5%左右.铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等.
铁在地壳中的含量约占 5%左右.铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等.(1)红热的铁能跟水蒸气反应,一种产物与磁铁矿的主要成分相同,另一种产物是可燃性气体,则其反应的化学方程式为
(2)在常温下,铁跟水不起反应.但在潮湿的空气中,铁很容易生锈(铁锈的主要成分是 Fe203)而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一.铁生锈的化学原理如下,请你用离子方程式和化学方程式补充完整.
①原电池反应:负极:2Fe-4e-=2Fe2+、正极:
②氢氧化物的形成:Fe2++2OH-=Fe(OH) 2↓
③氢氧化物的分解:2Fe(OH)3=Fe2O3+3H2O.
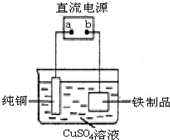
(3)为了防止铁生锈,可在铁制品表面镀上一层铜(如图装置),a为
考点:化学电源新型电池,金属的电化学腐蚀与防护
专题:电化学专题
分析:(1)金属铁在高温下和水蒸气反应生成四氧化三铁和氢气,根据燃料电池的工作原理来回答;
(2)金属铁在潮湿的空气下发生吸氧腐蚀,根据原电池原理来书写电极反应和总反应;
(3)在铁制品表面镀上一层铜,则金属铜是阳极,铁是阴极,电解质是含有铜离子的盐,根据电解池的工作原理来回答.
(2)金属铁在潮湿的空气下发生吸氧腐蚀,根据原电池原理来书写电极反应和总反应;
(3)在铁制品表面镀上一层铜,则金属铜是阳极,铁是阴极,电解质是含有铜离子的盐,根据电解池的工作原理来回答.
解答:
解:(1)金属铁在高温下和水蒸气反应生成四氧化三铁和氢气,即3Fe+4H2O
Fe3O4+4H2,在酸性条件下,制成氢氧燃料电池,负极反应为:H2-2e-=2H+,故答案为:3Fe+4H2O
Fe3O4+4H2;H2-2e-=2H+;
(2)①金属铁在潮湿的空气下发生吸氧腐蚀,正极上是氧气得电子的过程,故答案为:O2+4e-+2H2O=4OH-;
②氢氧化亚铁易被空气中的氧气氧化,原理是:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)在铁制品表面镀上一层铜,则金属铜是阳极,和电源的正极相连,正极,阴极上发生还原反应,即Cu2++2e-=Cu,故答案为:正极;Cu2++2e-=Cu.
| ||
| ||
(2)①金属铁在潮湿的空气下发生吸氧腐蚀,正极上是氧气得电子的过程,故答案为:O2+4e-+2H2O=4OH-;
②氢氧化亚铁易被空气中的氧气氧化,原理是:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)在铁制品表面镀上一层铜,则金属铜是阳极,和电源的正极相连,正极,阴极上发生还原反应,即Cu2++2e-=Cu,故答案为:正极;Cu2++2e-=Cu.
点评:本题涉及原电池、电解质的工作原理知识,注意知识的迁移和应用是解题关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关实验现象与其它三项不同的是( )
| A、向BaCl2溶液中通入少量CO2 |
| B、向饱和Na2CO3溶液中通CO2 |
| C、向Ba(OH)2溶液中滴加K2SO4溶液 |
| D、向Ca(OH)2溶液中通入少量CO2 |
 如图为实验室某浓硫酸酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓硫酸酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: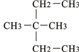 ③CH2=CH-CH3 ④氧气 ⑤氯水 ⑥
③CH2=CH-CH3 ④氧气 ⑤氯水 ⑥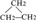 ⑧氯气 ⑨CH3CH2OH ⑩臭氧?
⑧氯气 ⑨CH3CH2OH ⑩臭氧?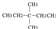 ?CH≡CH?
?CH≡CH?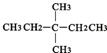 ?H2
?H2 向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:

