题目内容
12.在蒸发皿中将下列盐溶液蒸干并灼烧,能得到该物质的固体的是( )| A. | 氯化铝 | B. | 碳酸氢钠 | C. | 硫酸镁 | D. | 亚硫酸钠 |
分析 在蒸发皿中加热蒸干并灼烧下列物质的溶液可以得到该物质的固体,说明该溶质性质较稳定,蒸干、灼烧过程中不发生分解、不发生水解,据此分析解答.
解答 解:A.氯化铝在蒸干过程中发生水解,生成氢氧化铝和氯化氢,氯化氢易挥发,所以蒸干时得到氢氧化铝,灼烧氢氧化铝,氢氧化铝分解生成氧化铝,所以最终得到氧化铝,故A错误;
B.NaHCO3在加热条件下易分解生成碳酸钠、二氧化碳和水,故B错误;
C.加热促进硫酸镁水解,但硫酸没有挥发性,所以蒸干时得到的固体是硫酸镁,灼烧硫酸镁,硫酸镁不分解,所以最后得到的固体仍然是硫酸镁,故C正确;
D.Na2SO3不稳定,加热易被空气中氧气氧化,故D错误;
故选C.
点评 本题考查了盐类水解、物质的稳定性等知识点,根据盐类水解特点、物质的稳定性等知识点来分析解答,知道常见物质稳定性强弱,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)?MHx+2y(s)△H<0,达到化学平衡.下列有关叙述正确的是( )
| A. | 容器内气体压强保持不变 | |
| B. | 吸收ymolH2只需1 mo1MHx | |
| C. | 若向容器内通入少量氢气,则V(放氢)>V(吸氢) | |
| D. | 若降温,该反应的平衡常数增大 |
3.等物质的量浓度、等体积的氢氧化钠溶液和醋酸溶液完全反应后,溶液中有关离子浓度之间不存在的关系是( )
| A. | c(H+)•c(OH-)=KW | B. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | ||
| C. | c(Na+)=c(CH3COO-)+c(OH-) | D. | c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
20.下列各组离子中,在给定条件下能够大量共存的是( )
| A. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| B. | 无色溶液中:Mg2+、MnO4-、SO42-、K+ | |
| C. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| D. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- |
7.下列说法正确的是( )
| A. | 为了节约应将实验过程中取用的剩余药品放回原试剂瓶 | |
| B. | 在汽油罐上所贴的危险化学品标志内容是:遇湿易燃物品 | |
| C. | 酒精着火,迅速用湿抹布或沙子盖灭 | |
| D. | 氢氧化钠溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗 |
17.下列烷烃分子中,一氯取代产物最多的是( )
| A. | 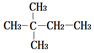 | B. | 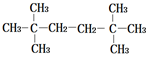 | ||
| C. | CH3CH2CH2CH2CH2CH3 | D. | CH3CH2CH2CH2CH2CH2CH3 |
4.VLFe2(SO4)3溶液中含有a克SO42-的溶液取0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量的浓度为( )
| A. | $\frac{a}{576V}$ mol•L-1 | B. | $\frac{a}{125}$ mol•L-1 | C. | $\frac{250a}{36V}$mol•L-1 | D. | $\frac{250a}{48V}$mol•L-1 |
1.下列事实中不能用平衡移动原理解释是( )
| A. | 密闭、低温是存放氨水的必要条件 | |
| B. | 实验室常用排饱和食盐水法收集氯气 | |
| C. | 打开汽水瓶时,有大量气泡冒出 | |
| D. | 已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol,工业上采用较高温度和使用催化剂以提高氨气的产率 |
2.在溶液中能大量共存,加入OH-有沉淀产生,加入H+有气体放出的是( )
| A. | Na+、Cu2+、Cl-、SO42- | B. | Fe3+、K+、SO42-、NO3- | ||
| C. | H+、Mg2+、OH-、NO3- | D. | Na+、Ca2+、Cl-、HCO3- |