题目内容
16.某温度下,向一定体积0.1mol•L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示,则( )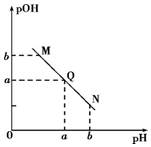
| A. | N点处pH>pOH,则N点处所示溶液呈酸性 | |
| B. | 该温度下水的离子积Kw=1×10-2a | |
| C. | Q点所示溶液呈中性,则M、N、Q三点中只有Q点溶液中水的电离出的c(H+)与水的电离c(OH-)相等 | |
| D. | M点所示溶液的导电能力强于Q |
分析 A.如果pOH>pH,则溶液中c(OH-)<c(H+),溶液呈酸性,同理如果pOH=pH,溶液呈中性,如果pOH<pH,则溶液呈碱性;
B.水的离子积常数Kw=c(OH-).c(H+);
C.任何电解质溶液中都存在水的电离出的c(H+)与水的电离c(OH-)相等;
D.电解质溶液导电性强弱与离子浓度成正比,与溶液酸碱性无关.
解答 解:A.如果pOH>pH,则溶液中c(OH-)<c(H+),溶液呈酸性,同理如果pOH=pH,溶液呈中性,如果pOH<pH,则溶液呈碱性,根据图知,所以M、Q、N点溶液分别为酸性、中性、碱性,故A错误;
B.水的离子积常数Kw=c(OH-).c(H+)=1×10-a.1×10-a=1×10-2a,故B正确;
C.任何电解质溶液中都存在水的电离出的c(H+)与水的电离c(OH-)相等,与溶液酸碱性无关,所以M、Q、N点溶液中都存在水的电离出的c(H+)与水的电离c(OH-)相等,故C错误;
D.电解质溶液导电性强弱与离子浓度成正比,与溶液酸碱性无关,M、Q点溶液中溶质都为醋酸钠和醋酸,但M点醋酸钠浓度小于Q点,所以M点离子浓度小于Q点,则Q点溶液导电能力强,故D错误;
故选B.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生图象分析、知识迁移能力及判断能力,明确溶液酸碱性判断方法、离子积常数计算方法及电解质溶液导电性强弱影响因素是解本题关键,易错选项是CD.

练习册系列答案
相关题目
6.在物质分类中,前者包括后者的是( )
| A. | 氧化物、化合物 | B. | 化合物、电解质 | ||
| C. | 溶液、胶体 | D. | 置换反应、氧化还原反应 |
7.常温下,用水稀释0.1mol•L-l CH3COOH溶液时,溶液中随着水量的增加而减小的是( )
| A. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ | B. | $\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$ | C. | c(H+)•c(OH-) | D. | OH-的物质的量 |
4.胶体区别于其它分散系的本质是( )
| A. | 胶体的分散质粒子直径在1nm~100nm之间 | |
| B. | 胶体粒子带电荷并且在一定条件下能稳定存在 | |
| C. | 胶体粒子不能穿过半透膜,能通过滤纸空隙 | |
| D. | 光束通过胶体时有丁达尔效应 |
11.2016年里约奥运会已经圆满结束,其中各种各样的材料为奥运会成功举办起到了举足轻重的作用.下列有关奥运材料的说法错误的是( )
| A. | 火炬燃料丙烷充分燃烧后只生成二氧化碳和水 | |
| B. | 撑杆跳高运动员使用的碳纤维撑杆属于有机高分子材料 | |
| C. | 泳池中加入的适量漂白粉可起到杀菌消毒作用 | |
| D. | 举重和体操运动员手上涂抹的碳酸镁白色粉末可吸水防滑 |
18.某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )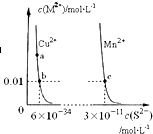

| A. | a点对应的 Ksp大于b点对应的Ksp | |
| B. | 向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)═CuS(s)+Mn2+(aq) | |
| C. | 在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)=2×10-23:1 | |
| D. | 该温度下,Ksp(CuS)小于Ksp(MnS) |
19. 已知三个反应如下:
已知三个反应如下:
Fe(s)+H2O(g)?FeO(s)+H2(g)△H1平衡常数为K1;
CO(g)+H2O(g)?H2(s)+CO2(g)△H2平衡常数为K2;
Fe(s)+CO2(g)?FeO(s)+CO(g)△H3平衡常数为K3;
在不同温度下,部分K1、K2的值如下:
(1)K1的表达式为$\frac{c({H}_{2})}{c({H}_{2}O)}$:根据反应I、II、III推导出K1、K2、K3的关系式K3=_$\frac{{K}_{1}}{{K}_{2}}$.
(2)要使反应I在一定条件下建立的平衡右移,可采取的措施有CE.(填字母)
A.缩小容器体积 B.降低温度 C.升高温度
D.使用合适的催化剂 E.设法减少H2的量 F.设法减少Fe0的量
(3)已知反应II在800℃可以自发进行,则△H2>0(填“>”、“<”或“=”),由以上信息推断反应III正反应方向为放热反应.(填“吸热”或“放热”)
(4)800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应II,反应在第6min时达到平衡,反应过程中测定的部分数据见表:
④反应在2min内的平均速率为v(H2O)=0.075mol/(L.min);
②800℃时,K2的值为1;
③若反应进行到某一时刻时,混合物中各组分的浓度分别为:c(CO)=0.002mol/L,
c(H2O)=0.003mol/L,c(CO2)=0.0025mol/L,c(H2)=0.0025moUL,则此时反应II中v(正)<v(逆).(填“>”、“<”或“=”)
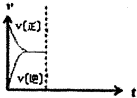
(5)在恒温恒压密闭容器中通入CO和H2O各1mol发生反应II,当反应达到平衡后,维持温度与压强不变,t1时再通入各l mol的CO和H2O的混合气体,请在图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图.
 已知三个反应如下:
已知三个反应如下:Fe(s)+H2O(g)?FeO(s)+H2(g)△H1平衡常数为K1;
CO(g)+H2O(g)?H2(s)+CO2(g)△H2平衡常数为K2;
Fe(s)+CO2(g)?FeO(s)+CO(g)△H3平衡常数为K3;
在不同温度下,部分K1、K2的值如下:
| T/℃ | 700℃ | 800℃ |
| K1 | 2.38 | 2.56 |
| K2 | 0.80 |
(2)要使反应I在一定条件下建立的平衡右移,可采取的措施有CE.(填字母)
A.缩小容器体积 B.降低温度 C.升高温度
D.使用合适的催化剂 E.设法减少H2的量 F.设法减少Fe0的量
(3)已知反应II在800℃可以自发进行,则△H2>0(填“>”、“<”或“=”),由以上信息推断反应III正反应方向为放热反应.(填“吸热”或“放热”)
(4)800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应II,反应在第6min时达到平衡,反应过程中测定的部分数据见表:
| 反应时间/min | 0 | 2 | 4 | 6 |
| N(CO)/mol | 1.20 | 0.90 | 0.80 | |
| N(H2O)/mol | 0.60 | 0.20 |
②800℃时,K2的值为1;
③若反应进行到某一时刻时,混合物中各组分的浓度分别为:c(CO)=0.002mol/L,
c(H2O)=0.003mol/L,c(CO2)=0.0025mol/L,c(H2)=0.0025moUL,则此时反应II中v(正)<v(逆).(填“>”、“<”或“=”)
(5)在恒温恒压密闭容器中通入CO和H2O各1mol发生反应II,当反应达到平衡后,维持温度与压强不变,t1时再通入各l mol的CO和H2O的混合气体,请在图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图.
 (1)对于反应:K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,回答下列问题:
(1)对于反应:K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,回答下列问题: