题目内容
5.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )| A. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- | |
| C. | 在铁的表面镀上一层锌,铁作阳极,电极反应式为:Zn2++2e-=Zn | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ |
分析 A.电解饱和食盐水,氯离子在阳极放电,氢离子在阴极放电;
B.负极上氢气失去电子;
C.镀上一层锌,Zn作阳极;
D.钢铁发生电化学腐蚀,负极上Fe失去电子,正极上可能氢离子得到电子或氧气得到电子.
解答 解:A.电解饱和食盐水时,阳极的电极反应式为2Cl--2e-=Cl2↑,阴极反应式为2H++2e-=H2↑,故A正确;
B.若电解质为酸,则氢氧燃料电池的负极反应式为H2-2e-=2H+,电解质为碱时负极反应为2OH-+H2-2e-=2H2O,故B错误;
C.在铁的表面镀上一层锌,锌作阳极,电极反应式为Zn-2e-=Zn2+,故C错误;
D.钢铁发生电化学腐蚀的负极反应式为Fe-2e-=Fe2+,故D错误;
故选A.
点评 本题考查电极反应的书写,为高频考点,把握离子的放电顺序、电极反应为解答的关键,侧重分析与应用能力的考查,注意电化学腐蚀中电解质影响电极反应,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
15.下列有关图示分析正确的是( )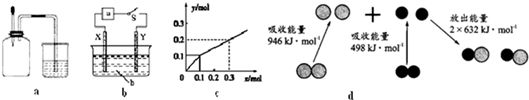

| A. | 如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶 | |
| B. | 如图b所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a | |
| C. | Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+ | |
| D. | 图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g)△H=-180 kJ/mol |
16.工业废气的氮氧化物(如NO、NO2等,用通式NOx表示)是主要的大气污染物之一.为了保护环境,工业上常通入氨气与之发生如下反应:NOx+NH3→N2+H2O.有关此反应,下列说法中错误的是( )
| A. | N2既是氧化产物又是还原产物 | |
| B. | 反应通式配平为6NOx+4xNH3=(3+2x)N2+6xH2O | |
| C. | 当x=1时,每生成2.5mol N2,被氧化的气体有3mol | |
| D. | 当x=2时,有1mol气体被还原时,转移的电子为4mol |
10.X、Y、Z三者均为短周期元素,已知X元素有一种同位素不含中子,Y元素原子的最外层电子数是次外层电子数的2倍,Z元素原子的最外层电子数是次外层电子数的3倍.下列化学式①XYZ3②X2YZ2③X2YZ3④X2Y2Z2⑤X2Y2Z4⑥X4Y2Z2中,并非都存在的一组分子是( )
| A. | ①② | B. | ④⑥ | C. | ③⑤ | D. | ②④ |
3.下列措施或事实不能用勒沙特列原理解释的是( )
| A. | 新制的氯水在光照下颜色变浅 | |
| B. | NO2和N2O4平衡混合气缩小体积加压后颜色变深 | |
| C. | 硫酸工业上SO2氧化成SO3,宜采用空气过量 | |
| D. | 煅烧硫铁矿利于SO2的生成 |