题目内容
6.A、B、C、D为原子序数依次增大的四种元素,A2-和B2+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:(1)四种元素中电负性最大的是O(填元素符号),其中C原子的次外层电子排布式为2s22p6.
(2)单质A有两种同素异形体,其中沸点高的是O3(填分子式),原因是O3相对分子质量较大,范德华力较大;B的氢化物所属的晶体类型是离子晶体,B单质所形成的晶体,一个晶胞平均含有2个原子.
(3)C和D反应可生成组成比为1:5的化合物E,E的分子式为PCl5,已知该分子的空间构
型为三角双锥,则其中两个Cl原子被F原子所替代得到的产物结构有3种.
(4)化合物D2A的立体构型为V形,中心原子的价层电子对数为4,单质D与Na2SO3
溶液反应,其离子方程式为Cl2+SO32-+H2O=2Cl-+SO42-+2H+.
(5)A和B能够形成化合物F,F晶体中的B2+离子的排列方式如下图所示,
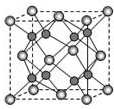
①每个B2+周围最近的等距离的B2+离子有个.
②已知F的晶胞参数是a0=0.54nm,它的密度为$\frac{4×40g/mol}{(0.54×1{0}^{-7}cm)^{3}×6.02×1{0}^{23}mo{l}^{-1}}$(只列式不作计算,阿伏加德罗常数为6.02×1023mol-1).
分析 C核外电子总数是最外层电子数的3倍,应为P元素,C、D为同周期元素,则应为第三周期元素,D元素最外层有一个未成对电子,应为Cl元素,A2-和B2+具有相同的电子构型;结合原子序数关系可知A为O元素,B为Mg元素,
(1)四种元素电负性最大的为O元素,C为P元素;
(2)A为O元素,有O2、O3两种同素异形体,O3相对分子质量较大,沸点较高,B的氢化物为MgH2,为离子晶体,B单质形成的晶体为镁晶体,为简单立方结构,根据均摊法确定晶胞中原子数目;
(3)C和D反应可生成化合物为PCl5,其空间构型为三角双锥,其中两个Cl原子被F原子所替代得到的产物中可以是双锥上的氯原子被替代,也可以是中间三角形上的两个氯原子被替代,也可以是一个锥上的氯和一个中间三角形上的氯被替代;
(4)化合物D2A为Cl2O,立体构型为V形,氯气与Na2SO3反应发生氧化还原反应,生成硫酸钠和盐酸,据此书写离子方程式;
(5)A和B能够形成化合物F为离子化合物,阴离子位于晶胞的定点和面心,阳离子位于晶胞的体心,则Na的个数为8,O的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
N(Na):N(O)=2:1,则形成的化合物为Na2O,计算质量和体积,可计算密度.
解答 解:C核外电子总数是最外层电子数的3倍,应为P元素,C、D为同周期元素,则应为第三周期元素,D元素最外层有一个未成对电子,应为Cl元素,A2-和B2+具有相同的电子构型,结合原子序数关系可知A为O元素,B为Mg元素,
(1)四种元素分别为O、Na、P、Cl,电负性最大的为O元素,C为P元素,P原子的次外层电子排布式为2s22p6,
故答案为:O;2s22p6;
(2)A为O元素,有O2、O3两种同素异形体,二者对应的晶体都为分子晶体,因O3相对分子质量较大,则范德华力较大,沸点较高,B的氢化物为MgH2,为离子晶体,B单质形成的晶体为镁晶体,为简单立方结构,根据均摊法可知,晶胞中原子数目为$8×\frac{1}{8}+1$=2,
故答案为:O3;O3相对分子质量较大,范德华力较大;离子晶体;2;
(3)C和D反应可生成组成比为1:5的化合物为PCl5,其空间构型为三角双锥,其中两个Cl原子被F原子所替代得到的产物中可以是双锥上的氯原子被替代,也可以是中间三角形上的两个氯原子被替代,也可以是一个锥上的氯和一个中间三角形上的氯被替代,所以得到的产物结构有3种,
故答案为:PCl5;3;
(4)化合物D2A为Cl2O,O为中心原子,形成2个δ键,孤电子对数为 $\frac{6-2×1}{2}$=2,则中心原子的价层电子对数为4,立体构型为V形,
氯气与湿润的Na2CO3反应可制备Cl2O,反应的方程式为Cl2+SO32-+H2O=2Cl-+SO42-+2H+,
故答案为:V形;4;Cl2+SO32-+H2O=2Cl-+SO42-+2H+;
(5)A和B能够形成化合物F为氧化镁,是离子化合物,阴离子位于晶胞的顶点和面心,阳离子位于晶胞的体心,则镁的个数为8,O的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,N(Mg):N(O)=1:1,每个Mg2+周围最近的等距离的Mg2+离子有12个,晶胞的质量为$\frac{4×40g/mol}{6.02×1{0}^{23}/mol}$,晶胞的体积为(0.54×10-7)cm3,
则晶体F的密度为$\frac{4×40g/mol}{(0.54×1{0}^{-7}cm)^{3}×6.02×1{0}^{23}mo{l}^{-1}}$,
故答案为:12;$\frac{4×40g/mol}{(0.54×1{0}^{-7}cm)^{3}×6.02×1{0}^{23}mo{l}^{-1}}$.
点评 本题考查了物质结构和性质,侧重考查学生空间想象能力、知识运用能力,涉及晶胞计算、原子结构等知识点,综合性较强,采用均摊法、价层电子对互斥理论等理论分析解答,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 体积不变,增加H2O(g)的量 | |
| B. | 保持体积不变,充入Ne使体系压强增大 | |
| C. | 将容器的体积缩小一半 | |
| D. | 压强不变,充入He使容器的体积增大 |
| A. | 标准状况下,11.2L四氯化碳所含分子数为0.5 NA | |
| B. | 1mol/L的盐酸溶液中,所含氯化氢分子数为NA | |
| C. | 80g硝酸铵含有氮原予数为2NA | |
| D. | 1mol氯气和铁反应时转移的电子数为3NA |
| A. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- | |
| C. | 在铁的表面镀上一层锌,铁作阳极,电极反应式为:Zn2++2e-=Zn | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ |
| A. | 在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,则原溶液中一定有CO32- | |
| B. | 如果某化学反应的△H和△S均小于0,则反应一定能自发进行 | |
| C. | 适量的Cl2通入FeI2溶液中可发生反应:3Cl2+6FeI2=2FeCl3+4FeI2 | |
| D. | 一定量氯气通入30mL 10mol•L-1的氢氧化钠溶液中,加热后形成NaCl、NaClO、NaClO3共存的溶液,若反应中转移的电子为n mol,则0.15<n<0.25 |
| A. | Al4C3晶体,熔点2200℃,熔融态不导电 | |
| B. | C3N4晶体具有比金刚石还大的硬度 | |
| C. | VF5晶体易溶于一些有机溶剂中 | |
| D. | BaCl2熔融状态下能够导电 |
| A. | HCN为V形分子 | |
| B. | NO3-的空间构型为三角锥形 | |
| C. | SF6中有6对完全相同的成键电子对 | |
| D. | SO42-和SO32-的中心原子均为sp3杂化 |
| A. | 用NaOH溶液吸收Cl2:Cl2+2OH-=2Cl-+H2O | |
| B. | Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 向AgCl悬浊液中加入Na2S溶液:2AgCl+S2-=Ag2S+2Cl- | |
| D. | 向NaHCO3-溶液中加入澄清石灰水:HCO+OH-=CO32-+H2O |
 ,最简单烯烃的结构简式为
,最简单烯烃的结构简式为 ,最简单芳香烃的分子式为C6H6,C4H10 的一氯代物有4种,C5H12 的同分异构体中沸点最低的物质 的结构简式为
,最简单芳香烃的分子式为C6H6,C4H10 的一氯代物有4种,C5H12 的同分异构体中沸点最低的物质 的结构简式为 .
.