题目内容
14.向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色.如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色.完成下列填空:(1)写出并配平CCl4层由紫色变成无色的化学反应方程式:

(2)整个过程中的还原剂是I2.
(3)把KI换成KBr,则CCl4层变为橙红色,继续滴加氯水,CCl4层的颜色没有变化.Cl2、HIO3、HBrO3氧化性由强到弱的顺序是HBrO3>Cl2>HIO3.据此判断下列反应能否进行HBrO3+HCl→Br2+Cl2+H2O(未配平)能.(填“能”或“否”)
(4)加碘盐中含碘量为20mg~50mg/kg.制取加碘盐(含KIO3的食盐)1000kg,若用Kl与Cl2反应制KIO3,至少需要消耗Cl210.58L.(标准状况,保留2位小数)
分析 (1)CCl4层由紫色变成无色,可知氯气和I2反应生成HCl、2HIO3;
(2)根据化合价变化判断氧化剂和还原剂;
(3)氧化剂和还原剂反应生成氧化产物和还原产物,氧化剂氧化性大于氧化产物的氧化性;
(4)由题意可知,碘化钾与氯气反应生成碘酸钾和氯化氢,化学方程式KI+3Cl2+3H2O=KIO3+6HCl,计依据化学方程式计算消耗的氯气的物质的量,依据V=nVm计算标况下,消耗的氯气的气体,按最小值计算.
解答 解:(1)氯气具有强氧化性,向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色,说明生成I2,继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色,说明I2被进一步氧化,生成HIO3,同时氯气被还原为HCl,反应的方程式为5Cl2+I2+6H20=2HIO3+10HCl,
故答案为:5Cl2+I2+6H20=2HIO3+10HCl;
(2)在Cl2+I2+H20→HIO3+HCl反应,I元素的化合价升高,被氧化,I2在反应中做还原剂,
故答案为:I2;
(3)氯气的氧化性比溴强,将KI换成KBr,则生成Br2,则CCl4层变为棕色,继续滴加氯水,CCl4层的颜色没有变化,说明氧化性HBrO3>Cl2,根据氧化剂和还原剂反应生成氧化产物和还原产物,氧化剂氧化性大于氧化产物的氧化性,则有Cl2>HIO3,所以氧化性顺序为HBrO3>Cl2>HIO3,氧化性HBrO3>Cl2,所以HBrO3+HCl→Br2+Cl2+H2O能进行,故答案为:HBrO3>Cl2>HIO3;能;
(4)1000kg加碘食盐中含碘20g,KI+3Cl2+3H2O=KIO3+6HCl,则
KIO3~I~KI~3Cl2,
127g 3mol
20g n
解得n=$\frac{20×3}{127}$(mol),标况下氯气的气体V=nVm=$\frac{20×3}{127}$mol×22.4L/mol=10.58L,
故答案为:10.58.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化及物质的量关系为解答的关键,侧重分析与应用、计算能力的考查,注意氧化性的比较方法,题目难度不大.

 阅读快车系列答案
阅读快车系列答案(1)某同学进行了如下实验,请完成实验内容.
| 序号 | 实验操作 | 实验结论 |
| 1 | 将D溶液分别加入其他溶液中时,B、E中有气体产生 | D的化学式为NaHSO4 |
| 2 | 将B溶液和C溶液混合时,无明显现象,再向混合溶液中加入D溶液,仍无明显现象. | C的化学式NaClO E的化学式KHCO3 |
| A. | CH2=CH-CH=CH2 | B. | CH≡C-CH=CH2 | C. |  | D. |  |
| A. | 某物质的焰色呈黄色,说明该物质一定含有钠元素,不含钾元素 | |
| B. | 氧化钠和过氧化钠和酸均能反应生成盐和水,因此都是碱性氧化物 | |
| C. | 氧化钠和过氧化钠的阴阳离子比前者为1:2,后者为1:1 | |
| D. | 把过氧化钠投入滴有酚酞的水中,溶液先变红后褪色. |
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度均降低 | |
| B. | SO2能使品红溶液和溴水均褪色 | |
| C. | 氯水和浓硝酸均要盛装在棕色试剂瓶中 | |
| D. | NaCl固体中混有NH4Cl或I2,均可用加热法除去 |
| A. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| B. | 食盐溶液能导电,所以它是电解质 | |
| C. | NaHSO4无论在水溶液里还是在熔融状态下都可以电离出Na+、H+和SO42- | |
| D. | SO3的水溶液可以导电,但它不是电解质 |
| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ②③④ |
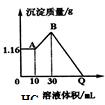 把NaOH、MgSO4、Al2(SO4)3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入2mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图.试回答:(写出计算过程)
把NaOH、MgSO4、Al2(SO4)3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入2mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图.试回答:(写出计算过程)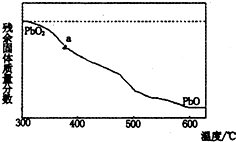 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3