题目内容
12.下列说法正确的是( )| A. | 任何情况下,温度都不可能对反应的方向起决定性作用 | |
| B. | pH=4的CH3COOH和NH4Cl溶液中,水的电离程度相同 | |
| C. | 用pH试纸测定溶液pH的正确操作是,将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照 | |
| D. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
分析 A.反应自发进行的判断依据是△H-T△S<0,如△H>0,△S>0,高温下反应能自发进行,低温下不能自发进行,温度可能对反应的方向起决定性作用;
B.醋酸抑制了水的电离,氯化铵促进了水的电离;
C.pH试纸直接浸入待测液,这样会污染溶液;
D.pH相差2,氯离子浓度相差100倍,PH=4.5的番茄汁中c(H+)是PH=6.5的牛奶中c(H+)的100倍.
解答 解:A.如△H>0,△S>0,高温下反应能自发进行,低温下不能自发进行,温度可能对反应的方向起决定性作用,故A错误;
B.pH=4的CH3COOH和NH4Cl溶液中,前者抑制了水的电离,后者促进了水的电离,所以两溶液中水的电离程度不相同,故B错误;
C.测定pH最简单的方法是使用pH试纸,测定时用玻璃棒蘸取待测溶液,滴在试纸上,然后再与标准比色卡对照,便可测出溶液的pH,不能将pH试纸直接浸入待测液,故C错误;
D.pH=4.5的溶液中c(H+)=10-4.5 mol•L-1,pH=6.5的溶液中c(H+)=10-6.5mol•L-1,所以前者溶液中c(H+)是后者溶液中氢离子浓度的100倍,故D正确;
故选D.
点评 本题考查了溶液pH的简单计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
2.将0.02molNa分别投入到盛有100mL水、100 mL 1mol•L-1盐酸、100mL 1mol•L-1硫酸铜溶液的X、Y、Z三个烧杯中,下列有关说法错误的是( )
| A. | 三个烧杯中一定均会发生的离子反应有:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 三个烧杯中钠均在液面上剧烈反应 | |
| C. | Z烧杯中一定会有沉淀生成,但沉淀不是单质铜 | |
| D. | 三个烧杯中生成氢气的物质的量相同 |
3.下列说法正确的是( )
| A. | pH在5.6~7.0之间的降水通常称为酸雨 | |
| B. | 海水资源的利用包括水资源的利用和化学资源的利用,两者可以综合进行 | |
| C. | 工业上用电解饱和氯化钠溶液的方法制得金属钠 | |
| D. | 含磷合成洗涤剂易于被细菌分解,故不会导致水体污染 |
20.下列说法正确的是( )
| A. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| B. | 用惰性电极电解MgCl2溶液的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 为验证盐桥的作用,在两个烧杯中分别盛适量硫酸亚铁铵溶液和稀酸性高锰酸钾溶液,分别插入石墨棒用导线与电流计相连,然后用装有K2SO4饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色 | |
| D. | 嫦娥三号月球车玉兔号在进入第二个月夜休眠前,出现了机构控制异常情况,其病因或为月尘,即月球上直径小于10微米的浮尘,月尘分散在空气中形成的分散系属于胶体 |
17.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
| A. | 先滴加BaCl2溶液再滴加HCl溶液,生成白色沉淀,原溶液中有SO42- | |
| B. | 滴加氯水和CCl4,振荡、静置,上层溶液显紫色,原溶液中有I- | |
| C. | 用洁净铁丝蘸取溶液进行焰色反应,火焰呈黄色,原溶液中有Na+ | |
| D. | 滴加NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中无NH4+ |
1.合金在现代生产、生活中应用非常广泛,因为它有许多优良的特性,下列关于合金性质的说法错误的是( )
| A. | 多数合金的硬度一般比其各成分金属的硬度高 | |
| B. | 多数合金的熔点一般比其各成分金属的熔点低 | |
| C. | 合金中可以含有非金属元素 | |
| D. | 合金的化学性质一般与其各成分金属的化学性质不同 |
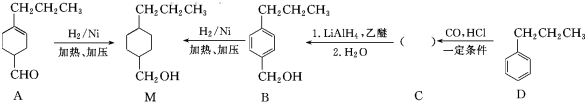
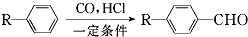
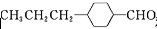 和
和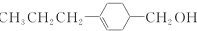 (写结构简式)生成.
(写结构简式)生成.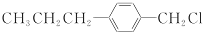 .
.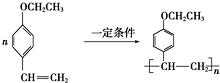 .
.
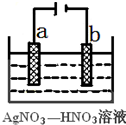 (1)由下列物质冶炼相应金属时采用电解法的是bd.
(1)由下列物质冶炼相应金属时采用电解法的是bd.