题目内容
3.下列说法正确的是( )| A. | pH在5.6~7.0之间的降水通常称为酸雨 | |
| B. | 海水资源的利用包括水资源的利用和化学资源的利用,两者可以综合进行 | |
| C. | 工业上用电解饱和氯化钠溶液的方法制得金属钠 | |
| D. | 含磷合成洗涤剂易于被细菌分解,故不会导致水体污染 |
分析 A.pH小于5.6的降水属于酸雨;
B.海洋约占地球表面积的71%,是一个远未完全开发的巨大化学资源宝库;
C.钠离子在水溶液中不放电;
D.含磷合成洗涤剂中磷元素是植物的营养元素.
解答 解:A.pH小于5.6的降水属于酸雨,正常雨水的pH值为5.6,故A错误;
B.海洋约占地球表面积的71%,是一个远未完全开发的巨大化学资源宝库,海水水资源的利用和海水化学资源的利用具有非常广阔的前景,故B正确;
C.钠离子在水溶液中不放电,故应电解熔融的氯化钠来制备金属钠,故C错误;
D.含磷合成洗涤剂中磷元素是植物的营养元素,会造成浮游植物的疯长导致水体缺氧,动植物植物大量死亡,故D错误.
故选B.
点评 本题考查环境污染及治理,为高频考点,侧重于化学与生活、生产、能源与环境的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案
相关题目
15.二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,.
回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O
(2)滤渣B的主要成分是Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+,Zn2+杂质,可能原因是CuS、ZnS的溶解度较MnS小.
(4)碱性锌锰干电池在放电时,电池的总反应方程式可以表示为:Zn+2MnO2+2H2O═Zn(OH)2+2MnOOH,该电池的正极反应式为2MnO2+2H2O+2e-═2MnOOH+2OH-.

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,.
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 |
| 沉淀物 | CuS | ZnS | MnS | FeS | ||
| Ksp | 8.5×10-45 | 1.2×10-23 | 1.4×10-15 | 3.7×10-14 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O
(2)滤渣B的主要成分是Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+,Zn2+杂质,可能原因是CuS、ZnS的溶解度较MnS小.
(4)碱性锌锰干电池在放电时,电池的总反应方程式可以表示为:Zn+2MnO2+2H2O═Zn(OH)2+2MnOOH,该电池的正极反应式为2MnO2+2H2O+2e-═2MnOOH+2OH-.
14.比较是化学学习中的一种重要方法.下列各组比较中不正确的是( )
| A. | 在相同条件下的溶解度:NaHCO3>Na2CO3 | |
| B. | 还原性:I->Br->Cl->F- | |
| C. | 氧化性:F2>Cl2>Br2>I2 | |
| D. | 碳酸氢钠溶液与稀盐酸互滴时两种操作现象相同 |
11.下列实验设计和结论相符的是( )
| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| B. | 向稀硝酸中加入铁粉完全反应,所得溶液一定只含一种溶质 | |
| C. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| D. | 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净FeCl3溶液 |
18.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 0.2 mol Al与足量NaOH溶液反应,生成的H2体积为6.72L | |
| B. | 常温下pH=1的盐酸溶液中的H+离子数目为0.1NA | |
| C. | 铅蓄电池中,当正极增加9.6g时,电路中通过的电子数目为0.3NA | |
| D. | 11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4反应中,6 mol CuSO4能氧化白磷的分子数为1.1NA |
15.下列说法正确的是( )
| A. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | |
| B. | 铁片镀锌时,铁片与外电源的正极相连 | |
| C. | 以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO)•c(S{O}_{3})}{c(N{O}_{2})•c(S{O}_{2})}$的值及SO2转化率不变 |
12.下列说法正确的是( )
| A. | 任何情况下,温度都不可能对反应的方向起决定性作用 | |
| B. | pH=4的CH3COOH和NH4Cl溶液中,水的电离程度相同 | |
| C. | 用pH试纸测定溶液pH的正确操作是,将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照 | |
| D. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
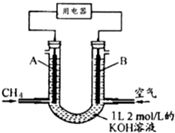 CH4燃料电池,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当0<V<44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O.
CH4燃料电池,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当0<V<44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O.