题目内容
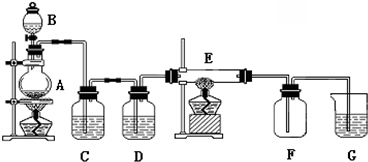
8. 常温下,向20ml某浓度的硫酸溶液中滴入0.1mol•l-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
常温下,向20ml某浓度的硫酸溶液中滴入0.1mol•l-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )| A. | V=40 | |
| B. | C点所示溶液中:c(H+)-c(OH-)═2c(NH3•H2O) | |
| C. | d点所示溶液中:c(NH4+)═2c(SO42-) | |
| D. | NH3•H2O的电离常数K=10-4 |
分析 A.c点水电离程度最大,说明此时铵根离子浓度最大,对水的电离促进程度最大;
B.根据质子守恒分析解答;
C.根据电荷守恒结合溶液呈中性分析解答;
D.根据40mL时溶液pH计算出氢离子、氢氧根离子浓度,然后结合物料守恒计算出一水合氨浓度,然后根据Ka=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$计算.
解答 解:A.c点水电离程度最大,说明此时铵根离子浓度最大,对水的电离促进程度最大,所以两者恰好完全反应生成硫酸铵,而稀硫酸的浓度为0.05mol/L,所以氨水的体积也是20ml,即V=20,故A错误;
B.c点所示溶液是硫酸铵溶液,溶液中质子守恒:c(H+)=c(NH3.H2O)+c(OH-),所以溶液中存在:c(H+)-c(OH-)=c(NH3.H2O),故B错误;
C.根据电荷守恒:c(H+)+c(NH4+)=2c(SO42-)+c(OH-),而溶液呈中性c(OH-)=c(H+),所以c(NH4+)=2c(SO42-),故C正确;
D.加入20mL氨水时两溶液恰好反应,此时c(H+)=5×10-6mol/L,c(OH-)=
| 10-14 |
| 5×10-6 |
| c(NH4+)•c(OH-) |
| c(NH3•H2O) |
| 0.05×2×10-9 |
| 5×10-6 |
故选C.
点评 本题考查弱电解质的电离、混合溶液的酸碱性判断等,侧重考查学生分析判断及识图能力,明确图中曲线变化趋势及每一点溶液中溶质成分及其性质是解本题关键,注意电荷守恒的灵活运用,题目难度中等.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
16.能够快速、微量、精确地测定相对分子质量的物理方法是( )
| A. | 红外光谱 | B. | 质谱 | C. | 核磁共振谱 | D. | 紫外光谱 |
13.根据下列结构示意图,判断下列说法中正确的是( )
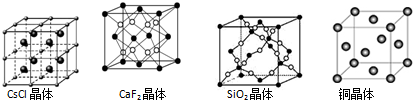

| A. | 在CsCl晶体中,距Cs+最近的Cl-有6个 | |
| B. | 在CaF2晶体中,Ca2+周围距离最近的F-有4个 | |
| C. | 在SiO2晶体中,每个晶胞中含有4个Si原子和8个O原子 | |
| D. | 在铜晶体中,每个铜原子周围距离最近的铜原子有12个 |
8.将下列物质熔化:氢氧化钠、二氧化硅、氧化钙、冰,需要克服的微粒间的相互作用 ①共价键 ②离子键 ③分子间作用力、氢键,正确的顺序是( )
| A. | .①②②③ | B. | ②③②① | C. | ②①②③ | D. | ①①②③ |
 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.
连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.