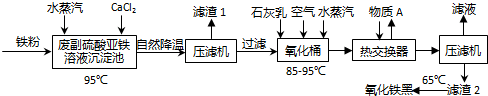
题目内容
13.根据下列结构示意图,判断下列说法中正确的是( )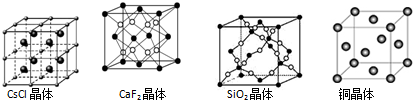
| A. | 在CsCl晶体中,距Cs+最近的Cl-有6个 | |
| B. | 在CaF2晶体中,Ca2+周围距离最近的F-有4个 | |
| C. | 在SiO2晶体中,每个晶胞中含有4个Si原子和8个O原子 | |
| D. | 在铜晶体中,每个铜原子周围距离最近的铜原子有12个 |
分析 A.氯化铯晶体中,铯离子的配位数是8;
B.根据晶胞结构图可知,每个晶胞中含有大白空心球的个数为8,而小黑球的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,结合CaF2的化学式可知,大白空心球表示F-,小黑球表示Ca2+;
C.根据晶胞中原子个数的计算方法计算原子个数,注意二氧化硅晶体中存在四面体结构单元,每个硅原子能构成四个共价键,每个氧原子能形成2个共价键,Si处于中心,O处于4个顶角;
D.以顶点Cu原子为研究对象,与之最近的Cu原子位于面心,每个顶点为8个晶胞共用.
解答 解:A.在CsCl晶体中,每个Cs+周围与其距离最近的Cl-有8个,故A错误;
B.在CaF2晶体中,每个F-周围最近距离的Ca2+分布在一个顶点以及和这个顶点相连的三个面的面心上,一共是4个,每个Ca2+被8个F-所包围,故B错误;
C.在二氧化硅晶胞中有8个硅原子位于立方晶胞的8个顶角,有6个硅原子位于晶胞的6个面心,还有4个硅原子与16个氧原子在晶胞内构成4个硅氧四面体,它们均匀错开排列于晶胞内,所以每个晶胞中含有8个Si原子和16个O原子,故C错误;
D.以顶点Cu原子为研究对象,与之最近的Cu原子位于面心,每个顶点为8个晶胞共用,铜晶体中每个铜原子周围距离最近的铜原子数目为$\frac{3×8}{2}$=12,故D正确;
故选D.
点评 本题考查晶体结构,明确晶胞结构是解本题关键,难点是配位数的计算,难度中等,注意掌握晶胞中配位数的计算方法,试题培养了学生的灵活应用能力.

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
4.科学家预言,燃料电池将是 21 世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极催化剂,工作原理是将电极插入KOH溶液中,然后在两极分别添加甲醇和氧气,若a极上添加甲醇; b极:2H2O+O2+4e-═4OH-. 关于此燃料电池的下列说法中错误的是( )
| A. | a极为负极,b极为正极 | |
| B. | 放电过程中,a、b电极上均发生氧化还原反应 | |
| C. | 该电池工作时添加甲醇的一极,附近溶液的 pH 降低,反应的离子方程式为:CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 若用此电源电解饱和食盐水,每消耗 0.1molO2则阳极理论上生成 0.2molCl2. |
8. 常温下,向20ml某浓度的硫酸溶液中滴入0.1mol•l-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
常温下,向20ml某浓度的硫酸溶液中滴入0.1mol•l-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
 常温下,向20ml某浓度的硫酸溶液中滴入0.1mol•l-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
常温下,向20ml某浓度的硫酸溶液中滴入0.1mol•l-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )| A. | V=40 | |
| B. | C点所示溶液中:c(H+)-c(OH-)═2c(NH3•H2O) | |
| C. | d点所示溶液中:c(NH4+)═2c(SO42-) | |
| D. | NH3•H2O的电离常数K=10-4 |
18.下列叙述中,肯定甲金属比乙金属活泼性强的是( )
| A. | 甲原子的最外层电子数比乙原子的最外层电子数少 | |
| B. | 甲原子电子层数比乙原子的电子层数多 | |
| C. | 1mol 甲从酸中置换H+生成的H2比1 mol 乙从酸中置换H+生成的H2多 | |
| D. | 常温时,甲能从水中置换出氢,而乙不能 |
5.下列物质有颜色的是( )
| A. | 食盐溶液 | B. | 氯化钙溶液 | C. | 苏打水 | D. | 饱和氯水 |
12.下列有机物常温下呈液态的是( )
| A. | CH3(CH2)2CH3 | B. | CH3(CH2)15CH3 | C. | CHCl3 | D. | CH3Cl |
13.下列化学用语正确的是( )
| A. | 氯化氢的电子式 | B. | 镁的原子结构示意图 | ||
| C. | 乙酸的结构简式C2H4O2 | D. | HClO的结构式H-Cl-O |