题目内容
19. 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.
连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.(1)连二次硝酸中氮元素的化合价为+1.
(2)常温下,用0.01mol•L-1的溶液NaOH滴定10mL0.01mol•L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示.
①写出H2N2O2在水溶液中的电离方程式:H2N2O2?HN202-+H+.
②c点时溶液中各离子浓度由大到小的顺序为c(Na+))>c(N2022-)>c(OH-)>c(HN202-)>c(H+).
③b点时溶液中c(H2N2O2)>(填“>”“<”或“=”,下同)c(N2O22-).
④a点时溶液中c(Na+)>c(HN2O2-)+C(N2O22-).
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中$\frac{c({N}_{2}{O}_{2}^{2-})}{c(S{O}_{4}^{2-})}$=3.0×10-4.[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5].
分析 (1)根据H2N2O2中H、O元素的化合价分别为+1、-2及总化合价之和为0进行计算N元素的化合价;
(2)①根据图象可知,0.01mol/L的H2N2O2溶液的pH=4.3,说明H2N2O2为二元弱酸,二元弱酸只要以第一步电离为主,据此写出其电离方程式;
②c点滴入20mL相同浓度的NaOH溶液,反应后溶质为Na2N2O2,HN202-部分水解,溶液呈碱性,结合电荷守恒判断各离子浓度大小;
③c点溶质为NaHN202,溶液呈碱性,则HN202-的水解程度大于其电离程度;
④a点时溶液的pH=7,则c(OH-)=c(H+),根据电荷守恒可知c(Na+)=c(HN202-)+2c(N2O22-);
(3)根据$\frac{c({N}_{2}{O}_{2}^{2-})}{c(S{O}_{4}^{2-})}$=$\frac{{K}_{sp}(A{g}_{2}{N}_{2}{O}_{2})}{{K}_{sp}(A{g}_{2}S{O}_{4})}$及二者的溶度积进行计算.
解答 解:(1)H2N2O2分子中H的化合价为+1,O元素的化合价为-2,设N元素的化合价为x,根据总化合价之和为0可知:2x+(+1)×2+(-2)×2=0,解得:x=1,即N元素的化合价为+1,
故答案为:+1;
(2)①根据图象可知,氢氧化钠溶液体积为0时,0.01mol/L的H2N2O2溶液的pH=4.3,说明H2N2O2为二元弱酸,二元弱酸只要以第一步电离为主,则其电离方程式为:H2N2O2?HN202-+H+,
故答案为:H2N2O2?HN202-+H+;
②c点滴入20mL相同浓度的NaOH溶液,反应后溶质为Na2N2O2,HN202-部分水解,溶液呈碱性,则:c(OH-)>c(H+),由于溶液中氢氧根离子还来自水的电离及HN202-的水解,则c(OH-)>c(HN202-),溶液中离子浓度大小为:c(Na+))>c(N2022-)>c(OH-)>c(HN202-)>c(H+),
故答案为:c(Na+))>c(N2022-)>c(OH-)>c(HN202-)>c(H+);
③c点溶质为NaHN202,溶液的pH<,说明溶液显示碱性,则HN202-的水解程度大于其电离程度,所以c(H2N2O2)>c(N2O22-),
故答案为:>;
④根据图象可知,a点时溶液的pH=7,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒可知c(Na+)=c(HN202-)+2c(N2O22-),所以c(Na+)>c(HN202-)+2c(N2O22-),
故答案为:>;
(3)当两种沉淀共存时,$\frac{c({N}_{2}{O}_{2}^{2-})}{c(S{O}_{4}^{2-})}$=$\frac{{K}_{sp}(A{g}_{2}{N}_{2}{O}_{2})}{{K}_{sp}(A{g}_{2}S{O}_{4})}$=$\frac{4.2×1{0}^{-9}}{1.4×1{0}^{-5}}$=3.0×10-4,
故答案为:3.0×10-4.
点评 本题考查了离子浓度大小比较、难溶物溶度积的计算,题目难度中等,明确反应后溶质组成及难溶物溶度积的表达式即可解答,试题侧重考查学生的分析、理解能力及化学计算能力.

 名校课堂系列答案
名校课堂系列答案| A. | 含有食品添加剂的物质均对人体健康有害 | |
| B. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| C. | 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl | |
| D. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
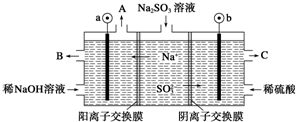
| A. | 图中a极连接电源的负极 | |
| B. | A口放出的物质是氢气,C口放出的物质是氧气 | |
| C. | b极电极反应式为:SO32--2e-+H2O═SO42-+2H+ | |
| D. | 电解过程中阴极区碱性明显增强 |
| A. | 将CO中毒者移到通风处抢救 | |
| B. | 不慎将浓硫酸溅到皮肤上,应立即用少量水冲洗 | |
| C. | 不慎碰倒酒精灯,洒出的酒精在桌上燃烧时,应立即用湿抹布盖灭 | |
| D. | 眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉 |
| A. | a极为负极,b极为正极 | |
| B. | 放电过程中,a、b电极上均发生氧化还原反应 | |
| C. | 该电池工作时添加甲醇的一极,附近溶液的 pH 降低,反应的离子方程式为:CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 若用此电源电解饱和食盐水,每消耗 0.1molO2则阳极理论上生成 0.2molCl2. |
| A. | 等体积的0.010mol/LB(OH)2溶液与0.010mol/LH2SO4溶液恰好完全反应 | |
| B. | 0.010mol/LB(OH)2溶液能使红色石蕊试液变蓝 | |
| C. | 0.010mol/LBCl2溶液呈酸性,0.010mol/LB2CO3溶液呈中性 | |
| D. | 0.010mol/LB(OH)2溶液能够与NH4Cl反应生成NH3(g) |
 常温下,向20ml某浓度的硫酸溶液中滴入0.1mol•l-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
常温下,向20ml某浓度的硫酸溶液中滴入0.1mol•l-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )| A. | V=40 | |
| B. | C点所示溶液中:c(H+)-c(OH-)═2c(NH3•H2O) | |
| C. | d点所示溶液中:c(NH4+)═2c(SO42-) | |
| D. | NH3•H2O的电离常数K=10-4 |
| A. | 气态氢化物的稳定性:H2O>H2S>SiH4 | |
| B. | 离子半径:Cl->O2->Mg2+ | |
| C. | 物质酸性:H3PO4>H2SO4>HClO4 | |
| D. | 熔点:KCl>K |
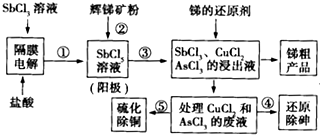 我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组设计的一种提取锑的工艺流程如图.
我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组设计的一种提取锑的工艺流程如图.