题目内容
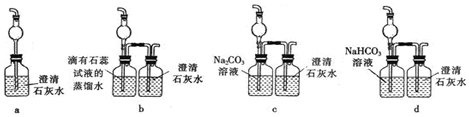
6.关于胶体的性质与应用,相关说法错误的是( )| A. | 静电除尘器除去空气中的飘尘是利用胶体粒子的带电性而加以除去 | |
| B. | 溶液和胶体均为呈电中性的分散系 | |
| C. | FeCl3溶液和Fe(OH)3胶体的本质区别是后者可以产生丁达尔现象 | |
| D. | 由于胶粒之间的排斥作用,胶粒不易聚集成大的颗粒,所以胶体比较稳定 |
分析 A.静电除尘利用的是胶体电泳现象;
B.溶液和胶体是呈电中性的分散系;
C.溶液和胶体的本质区别是分散质粒子直径不同;
D.胶体性质稳定的原因是胶体粒子带同种电荷,有相互排斥的作用力;
解答 解:A.中和胶体粒子的电性能够使胶体发生电泳,如用净电除尘器吸附带电的飘尘,而使之电泳除去,故A正确;
B.溶液和胶体均不带电,是呈电中性的分散系,故B正确;
C.FeCl3溶液与Fe(OH)3胶体的本质区别是分散质粒子直径不同,故C错误;
D.由于同种电荷的静电排斥作用,胶体相对比较稳定,故D正确;
故选C.
点评 本题考查了胶体的重要性质,难度不大,注意分散系属于混合物、胶体不带电、溶液和胶体的本质区别是分散质粒子直径不同而不是有无丁达尔效应.

练习册系列答案
相关题目
15.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是( )
| A. | 氯化硼分子间含有氢键 | |
| B. | 氯化硼中心原子采用sp杂化 | |
| C. | 氯化硼分子呈正三角形,属非极性分子 | |
| D. | 其分子空间结构类似CH4O |




 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
 CO2+4HCl.
CO2+4HCl.